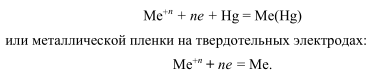какие электроды можно использовать в кулонометрии в качестве рабочих
Какие электроды можно использовать в кулонометрии в качестве рабочих
В кулонометрическом анализе требуются два рабочих электрода. Тот, на котором протекает необходимая электрохимическая реакция, называется генераторным (или рабочим), а второй — вспомогательным. Кроме того, для потенциостатической кулонометрии требуется электрод сравнения, относительно которого контролируется потенциал генераторного электрода. При кулонометрическом титровании, если применяются электрохимические методы индикации завершения химических реакций, следует дополнительно располагать соответствующими индикаторными электродами (см. гл. 11, III).
В качестве материалов для генераторных электродов могут быть использованы платина, золото, серебро, ртуть, амальгамы, графит и иногда вольфрам, медь, свинец, хром и пр. Наиболее часто применяются платина и ртуть; платина более пригодна для анодных процессов, а для катодных процессов — в тех случаях, когда электропревращение вещества протекает при более положительных значениях потенциала электрода, чем выделение водорода (из-за малого перенапряжения водорода на платине). На ртутном электроде можно осуществить почти все катодные процессы благодаря большому перенапряжению водорода на нем. Однако из-за легкости анодного растворения ртути проведение электролиза при несколько более положительных значениях потенциала, чем потенциал НВЭ, недопустимо. Таким образом, эти два электрода дополняют друг друга.
Золотой электрод подобен платиновому.
Серебряный электрод главным образом используется для генерации 

В некоторых случаях для увеличения перенапряжения водорода благородные металлы покрывают слоем ртути либо электролитически, либо выдержав их некоторое время в ртути; иногда пользуются соответствующими амальгамами.
Графитовый электрод позволяет работать в несколько более отрицательных областях потенциалов, чем электроды из благородных металлов, но из-за пористой структуры, обусловливающей адсорбцию веществ из раствора, он дает несколько менее воспроизводимые результаты измерения электрических параметров и высокий остаточный ток. Однако при соответствующей обработке (пропитка различными составами, например смолами, парафином и пр.) графит оказывается очень полезным генераторным (а так же индикаторным) электродом.
Металлические электроды могут иметь самые разнообразные формы; они используются в виде пластинок, проволок, спиралей, сеток и других форм. Графитовые электроды обычно имеют цилиндрическую форму; ртуть для получения электродов с большой поверхностью наливают на дно электролизера; в последнем случае электрический контакт осуществляют проволокой из благородного металла, впаянной в дно сосуда, другой конец которой контактирует с токопроводящей проволокой (медной).
Иногда металлические электроды припаивают к медной проволоке, затем спай и медную проволоку впаивают в стеклянную трубку. Перед работой поверхность твердых электродов подвергают обработке.
В зависимости от ранее проведенной электродной реакции ртуть в электролизере следует или заменить новой порцией, или подвергнуть кислотной обработке либо поляризации при соответствующих условиях.
В качестве вспомогательных электродов в основном служат электроды из благородного металла, чаще всего из платины, иногда из серебра (когда приходится избегать выделения на аноде газообразного хлора, разрушающего платину). Это дает возможность помещать вспомогательный электрод в одну камеру с генераторным электродом.
Электроды сравнения должны быть неполяризуемыми, т. е. сохранять потенциал постоянным при прохождении через них малых токов. Наибольшее применение в качестве электрода сравнения имеет Нас. КЭ, хотя с успехом могут быть использованы любые другие электроды сравнения.
Кулонометрия. Вольтамперометрия. Полярография
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Кулонометрия
Электролиз — химическая реакция окисления или восстановления на электроде под действием электрического тока. Для измерения количества, прошедшего через ячейку заряда, применяются кулонометры или электронные интеграторы. В кулонометре протекает известная реакция с 100%-ным выходом по току. Измерение массы образовавшегося в кулонометре вещества позволяет рассчитать прошедший заряд. Если будем проводить расчеты по массе выделившегося вещества, то это будет метод электрогравиметрии.
Кулонометрический метод анализа базируется на законах электролиза Фарадея:
1. Количество восстановленного или окисленного в результате электролиза вещества прямо пропорционально количеству прошедшего электричества.
2. Массы различных веществ, выделенных на электроде при прохождении 96500 Кл электричества, равны их электрохимическим эквивалентам:
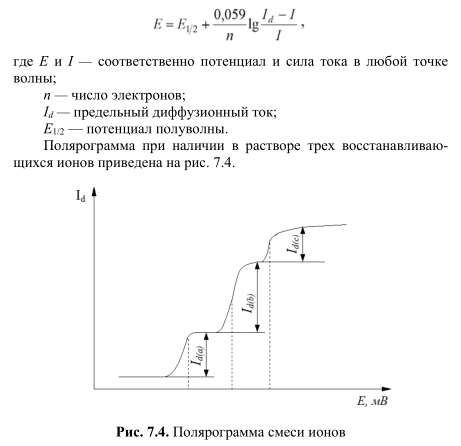
Если раствор содержит несколько компонентов, имеющих различные потенциалы разложения, можно выделять их из смеси в определенной последовательности, регулируя напряжение. При увеличении напряжения сначала выделяются на катоде металлы, имеющие меньший потенциал разложения. Например, из раствора ионов Pb+2 и Cd+2 (с единичными активностями) сначала будут восстанавливаться на катоде ионы свинца (E 0 Pb = –0,126 В, Е 0 Сd = –0,402 В). Если потенциал катода сделать равным –0,35 В, то будут восстанавливаться только ионы свинца, а ионы кадмия останутся в растворе.
Кулонометрия — высокочувствительный и точный метод анализа, позволяющий определить до 10 –9 г вещества. Однако необходимо правильно подобрать напряжение (потенциал) электролиза, для того чтобы исключить протекание побочных реакций. 7.5.
Вольтамперометрия
Это электрохимический метод анализа, основанный на использовании вольтамперных зависимостей I = f(E), которые получают в процессе электролиза на поляризуемом электроде. Метод основан на расшифровке кривых зависимости тока от потенциала (поляризационных кривых), измеренных в ячейке с поляризующимся индикаторным электродом и неполяризующимся электродом сравнения.
Если к системе электродов, погруженных в раствор, приложить напряжение, то по цепи будет проходить электрический ток. На электродах будут протекать электрохимические реакции окисления на аноде и восстановления на катоде. Ион может вступать в электрохимическую реакцию, только если достигается соответствующий окислительно-восстановительный потенциал. Нередко электрохимическая реакция все равно не протекает.
Причина этого в сложном механизме электрохимического процесса, который включает:
1) перенос вещества к поверхности электрода;
2) передачу электрона (данная стадия может быть обратимой и необратимой)
— реакция Fe3+ + е – = Fe2+ обратима;
— реакция MnO4 – + 8H+ + 5 е – = Mn2+ + 4H2O необратима);
3) отвод продуктов реакции
— перенос вещества от поверхности обратно в раствор;
— растворение вещества в материале электрода (в случае ртутного электрода);
— электрокристаллизация на поверхности электрода;
— выделение газа.
Скорость электрохимического процесса определяется самой медленной его стадией. Если скорость какой-либо из стадий равна нулю, процесс вообще не протекает. Графит, платина, свинец, цинк и ртуть обладают наибольшей поляризацией, а хлоридсеребряный, каломельный и медный электроды не поляризуются. Поляризация определяется рядом параметров, ее невозможно рассчитать, необходимо установить опытным путем.
Поляризация существенно влияет на ток, протекающий через электрохимическую ячейку. Рассмотрим две электродные системы, помещенные в раствор инертного фонового электролита. Система из медного рабочего электрода и неполяризованного электрода сравнения зависит от напряжения и описывается законом Ома. Такая электродная система не представляет интереса для электрохимического анализа.
Во второй электродной системе в качестве рабочего используется поляризуемый ртутный электрод. В области потенциалов от +0,2 до –2,0 В ток через электроды практически не протекает. За пределами этого диапазона ток резко увеличивается. (Катодный ток в области отрицательных потенциалов обусловлен восстановлением ионов водорода. В положительной области потенциалов анодный ток вызван растворением ртути в результате электрохимической реакции.)
В вольтамперометрии используются ячейки, состоящие из поляризуемого рабочего и неполяризуемого электрода сравнения. Требования к рабочему электроду:
Если первое требование легко выполняется за счет конструкции электрода, то второе целиком зависит от материала. Электроды из благородных металлов (платины, золота) и графита поляризованы в области потенциалов от +1,3 до –1,0 В. Катодный ток связан с восстановлением ионов водорода, а анодный — с выделением кислорода. Эти электроды имеют преимущество в анодной области потенциалов. В катодной области их использование ограничено.
Анализ проводится следующим образом. На электролитическую ячейку подают плавно возрастающее напряжение от внешнего источника и регистрируют протекающий в ней ток. Если в растворе отсутствуют электрохимически активные ионы, то получается зависимость I = f(Е).
Если в растворе присутствует электрохимически активные ионы, то наблюдается волна. Если потенциал рабочего электрода меньше потенциала выделения электрохимически активного компонента, то электрохимическая реакция на нем не протекает. Незначительный ток, протекающий через ячейку, связан с образованием на поверхности электрода двойного электрического слоя (ДЭС), который можно уподобить конденсатору. Чем больше ток ДЭС, тем ниже чувствительность метода.
Когда потенциал электрода достигает величины, равной потенциалу выделения электрохимически активного компонента, происходит деполяризация рабочего электрода. Ионы начинают разряжаться на рабочем электроде с образованием амальгам на ртутном электроде:
Через электрод протекает ток электролиза (фарадеев ток), который пропорционален напряжению. Концентрация ионов в приэлектродном слое уменьшается. Происходит перенос вещества из объема раствора к поверхности электрода. При этом ток достаточно мал (порядка 10 –5 А) и не влияет на концентрацию ионов в глубине раствора. Перенос вещества протекает исключительно за счет диффузии. На электроде разряжаются все поступающие из глубины раствора ионы. Протекающий через электрод ток зависит только от скорости диффузии, которая зависит не от напряжения электрода, а от концентрации раствора, коэффициента диффузии, формы и размера электрода.
Полярография.
В 1922 г. чешским ученым Я. Гейровским был разработан полярографический метод анализа. Он использовал ртутный капающий электрод. Вольтамперометрия, использующая ртутный капающий электрод, стала называться полярографией. За открытие и развитие полярографического метода анализа в 1959 г. Я. Гейровскому была присуждена Нобелевская премия. Зависимость между приложенным напряжением и силой тока в любой точке волны описывается уравнением Гейровского — Ильковича:
Потенциал полуволны не зависит от величины диффузионного тока и является качественной характеристикой иона. Если в растворе присутствует несколько ионов, потенциалы полуволн которых различаются более чем на 100 мВ, то на полярограмме наблюдается несколько волн. Величина потенциала полуволны обычно отличается от нормального окислительно-восстановительного потенциала вследствие:
● кинетической поляризации электрода;
● влияния адсорбционных явлений;
● влияния реакций комплексообразования и осаждения.
Большинство параметров уравнения зависят от свойств рабочего электрода и в процессе работы не изменяются. Поэтому их объединяют в константу k. В этом случае уравнение преобразуется к виду I = kс. Среди величин, включаемых в k, труднее всего экспериментально определить коэффициент диффузии. Поэтому коэффициент пропорциональности между концентрацией вещества и силой диффузионного тока обычно устанавливают с помощью стандартных растворов.
На твердотельных электродах наблюдаются максимумы, возникающие из-за высокой скорости наложения потенциала. Они подавляются подбором оптимальных условий записи полярограмм. Максимумы, связанные с осаждением вещества на электроде, не устраняются. Твердые электроды после записи каждой волны необходимо чистить.
Рис. 7.5. Полярограф АВС 1.1
По разнообразию решаемых задач вольтамперометрические методы являются наиболее универсальными среди методов электрохимического анализа. Они позволяют одновременно получать качественную и количественную информацию о находящихся в растворе электроактивных веществах, т. е. способных вступать в химические реакции под действием электрического тока.
Подбором соответствующих условий (растворителя, материала электродов, реагентов) самые различные вещества могут быть переведены в электроактивное состояние. Поэтому на сегодняшний день разработаны способы вольтамперометрического определения большинства элементов и весьма широкого круга неорганических и органических соединений в диапазоне концентраций от 10 –3 до 10 –11 мольл.
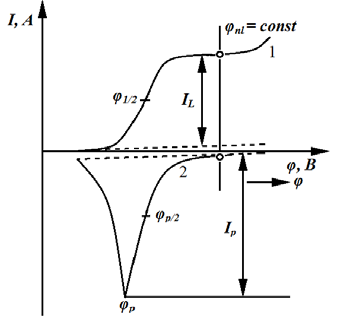
Инверсионная вольтамперометрия позволяет существенно увеличить чувствительность метода. Метод инверсионной полярографии заключается в выделении определяемого элемента из очень разбавленного раствора на ртутной капле, тонкой пленке ртути на графитовом электроде или просто на графитовом электроде электролизом с последующим анодным растворением полученного продукта. Процесс накопления определяемого компонента проходит при потенциале φ (рис. 7.6), соответствующем предельному току I /L.
Рис. 7.6. Принцип электрохомического инверсионного определения 1 — стадия накопления; 2 — стадия растворения
В настоящее время инверсионная вольтамперометрия является одним из важнейших методов определения следовых содержаний органических и неорганических соединений в растворах, а также анализа твердых материалов. Ее достоинства по сравнению с другими методами:
Амперометрическое титрование (потециостатическое поляризационное титрование) — это разновидность вольтамперометрического метода (наряду с полярографией). Метод основан на измерении величины тока между электродами электрохимической ячейки, к которым приложено некоторое постоянное напряжение, как функции прибавленного титранта. Определяемое вещество должно быть электрохимически активным.
При прибавлении титранта в анализируемый раствор концентрация этого вещества уменьшается или увеличивается, соответственно падает или возрастает диффузионный ток. Точку эквивалентности фиксируют по резкому изменению падения или роста диффузионного тока, что отвечает окончанию реакции титруемого вещества с титрантом. Вид кривой титрования зависит от того, какое вещество вступает в электрохимическую реакцию (рис. 7.8).
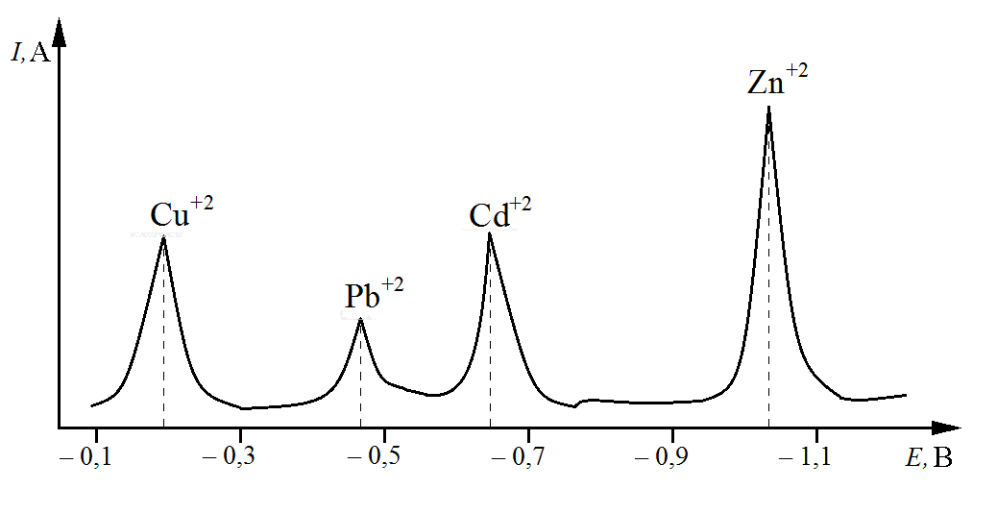
Рис. 7.7. Одновременное определение нескольких ионов металлов методом инверсионной вольтамперометрии
Рис. 7.8. Кривые амперометрического титрования а — активно титруемое вещество; б — активен титрант; в — активны титруемое вещество и титрант; г — активен продукт реакции
При амперометрическом титровании используются реакции осаждения, комплексообразования и окислительно-восстановительные. Если ни титрант, ни продукт реакции, ни определяемое вещество не являются электрохимически активными, то используют амперометрический индикатор. Это вещества, которые восстанавливаются или окисляются на электроде и взаимодействуют с титрантом после того, как определяемое вещество количественно вступит в реакцию. Поэтому диффузионный ток при титровании определяемого вещества постоянен, а после точки эквавалентности уменьшается.
Кулонометрический метод анализа



Кулонометрические методы анализа основаны на измерении количества электричества, израсходованного на электропревращение определяемого вещества.
· Теоретические основы метода
В основе кулонометрических методов лежат законы электролиза Фарадея.
Законы Фарадея формулируются следующим образом.
1. Количество электропревращенного (восстановленного или окисленного) в процессе электролиза вещества прямо пропорционально количеству прошедшего электричества.
2. Массы различных веществ, выделенных или растворенных при прохождении одного и того же количества электричества, пропорциональны их электрохимическим эквивалентам.
Электрохимический эквивалент – это масса вещества, выделившегося на электроде (или растворившегося с электрода) в процессе электролиза при протекании единицы количества электричества, т. е. 1 Кл.
Суть законов Фарадея заключается в том, что для выделения одного моля эквивалента любого вещества в процессе электролиза необходимо затратить одно и то же количество электричества, называемое числом Фарадея F=96500 Кл/моль.

m-масса выделяющегося вещества, г

Q – количество электричества (Кл),
n – число электронов, участвующих в электродной реакции).
где I – сила тока, А (ампер);
t – время электролиза, с (секунда).
Кулонометрические методы анализа обладают существенным преимуществом перед большинством других методов анализа.
Это связано с тем, что в соответствии с уравнением (1) коэффициент пропорциональности между аналитическим сигналом (Q) и массой определяемого вещества (m) содержит только физические константы (постоянные величины). Поэтому при использовании кулонометрических определений не требуется проводить градуировку аналитического сигнала по стандартным образцам (растворы сравнения), что является необходимым условием для большинства современных физических и физико-химических методов анализа.
Кроме того, кулонометрические методы анализа обеспечивают получение результатов с лучшей воспроизводимостью, чем большинство других методов анализа при определении как малых, так и сравнительно больших содержаний; они более экспрессны и легко автоматизируются.
В методе необходимо соблюдение трех обязательных условий:
–электрохимическое превращение вещества должно протекать со 100% выходом по току, т.е. побочные электродные реакции должны отсутствовать (только при этом условии можно воспользоваться законом Фарадея для вычисления количества определяемого вещества).
-кроме 100 % выхода по току для осуществления анализа необходимо определить окончание электродной реакции в прямой кулонометрии и химической реакции в кулонометрическом титровании, а также точно измерить количество электричества, затраченного на проведение электродной реакции.
–момент завершения электрохимической реакции должен быть достаточно точно устанавливаемым;
–количество электричества, вовлечённое в электродную реакцию, должно быть точно определяемо подходящим способом.
Различают два основных вида кулонометрических определений:
– косвенную (кулонометрическое титрование).
В методах прямой кулонометрии анализируемое вещество непосредственно подвергается электрохимическому превращению в кулонометрической ячейке, т.е. определяемое вещество электороактивно.
В методах косвенной кулонометрии определяемые вещества не электроактивны и тогда в их раствор вносят такое вещество, которое способно электроокисляться или электровосстанавливаться на электродах. Продукт этих реакций способен химически количественно взаимодействовать с определяемым веществом в эквивалентных количествах и количество электричества соответственно будет также эквивалентно содержанию определяемого вещества.
По технике выполнения кулонометрический метод анализа делится на:
–потенциостатическую кулонометрию (или кулонометрию при контролируемом потенциале)
– амперостатическую кулонометрию (или кулонометрию при постоянной силе тока)
· Метод потенциостатической кулонометрии (при контролируемом потенциале электрода)
Метод состоит в проведении электролиза раствора, содержащего определяемое вещество при постоянном, заранее выбранном потенциале рабочего электрода.
В методах прямой кулонометрии электрохимическому превращению непосредственно в кулонометрической ячейке подвергается анализируемое вещество.
В прямой кулонометрии измерения обычно проводят при постоянном контролируемом потенциале, т.е. в потенциостатическом режиме. Принципиальная схема установки для потенциостатической кулонометрии приведена на рис. 1.


Рис. 1. Схема установки для потенциостатической кулонометрии.
3-электрод сравнения (каломельный или хлорсеребряный)
Напряжение с аккумуляторной батареи 1 через делитель напряжения 2 подается на рабочий электрод 4 кулонометрической ячейки. Потенциал электрода определяется милливольтметром или потенциометром, сила тока – амперметром. Количество израсходованного электричества измеряется кулонометром 6.
Рабочим электродом кулонометрической ячейки обычно служит платиновая пластинка или ртуть, хотя иногда используют также золотые, серебряные или графитовые электроды.
Вспомогательный электрод изготовляется из тех же материалов.
Электродные пространства рабочего и вспомогательного электродов разделены. Контакт между ними осуществляется через пористую перегородку. В качестве электрода сравнения 3 (рис. 1) обычно выбирают каломельный или хлорсеребряный.
Определение количества электричества, израсходованное на протекание электрохимической реакции, производится путем измерения тока в течение всего процесса электролиза с последующим определением величины, соответствующего площади, ограниченной осями координат i-t кривой.
Эта операция может быть выполнена автоматически с помощью электронных интеграторов тока.
кулонометра, т.е. второй электрохимической ячейки.
Известны три основных типа кулонометров:
В весовых кулонометрах (к ним относятся серебряные и медные) количество прошедшего в них электричества рассчитывается по изменению массы катода или анода. В объемных кулонометрах расчет производится на основании измерения объема получающихся веществ (газа в водородном кулонометре, жидкой ртути в ртутном кулонометре). В титрационныхкулонометрах количествоэлектричества определяется по данным титрования веществ, образующихся в растворе в результате электродной реакции.
Этиловый спирт добавляют в электролит для получения более мелкокристаллических, компактных катодных осадков и с целью предотвращения окисления медных электродов кулонометра.
О количестве прошедшего электричества судят по изменению массы катода, до и после электролиза.
Медный кулонометр для небольших токов.
В кулонометре со 100%-ным выходом протекает хорошо известная электрохимическая реакция. Измерение количества электричества сводится к определению количества вещества, полученного в результате этого процесса, и расчета количества электричества по закону Фарадея.
В ходе электролиза из перемешиваемого раствора ток падает со временем по экспоненциальному закону, электролиз прекращают, когда ток достигает 0,1% начального значения. В некоторых случаях, например, при большом остаточном токе применяют химические или физико-химические способы индикации. Массу определяемого вещества рассчитывают по формуле