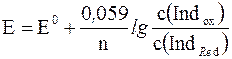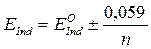визуально определить достижение точки эквивалентности нельзя
Способы определения точки эквивалентности



В то же время, исходные концентрации титруемого вещества и титранта не будут оказывать влияния на вид кривой титрования.
Наличие резкого скачка на кривой титрования позволяет определить точку эквивалентности непосредственно с помощью потенциометрических измерений или использовать для этих целей определённые окислительно-восстановительные (редокс) индикаторы, окраска которых изменяется в зависимости от величины потенциала системы.
В редоксиметрии точку эквивалентности можно определить с помощью различных инструментальных методов (например, потенциометрически) либо визуально.
Визуальное обнаружение конечной точки титрования может быть проведено по изменению окраски одного из участников протекающей реакции, либо с помощью индикаторов. Например, в перманганатометрии критерием достижения точки эквивалентности обычно служит появление неисчезающей розовой окраски вследствие добавления к бесцветному титруемому раствору одной лишней капли ярко-малинового раствора KМnO4.
Индикаторы, используемые для определения точки эквивалентности, могут быть специфическими либо окислительно-восстановительными.
Специфические индикаторы реагируют на изменение концентрации одного из участников химической реакции, протекающей при титровании, образуя с ним нестойкое яркоокрашенное соединение.
Оно легко может разрушаться при добавлении второго реагента. Например, в иодометрии для этих целей используют раствор крахмала, образующий с I2 соединение ярко-синего цвета. По исчезновении (в результате расходования I2) или возникновении (при добавлении лишней капли раствора I2) синей окраски судят о достижении точки эквивалентности.
Окислительно-восстановительными, или редокс-индикаторами, называются вещества, которые изменяют свою окраску в зависимости от величины окислительно-восстановительного потенциала системы.
Под действием окислителя или восстановителя в структуре молекулы редокс-индикатора происходят изменения, вызывающие возникновение новой окраски. Таким образом, в растворе редокс-индикатора существует равновесие между его окисленной и восстановленной формами, имеющими разную окраску, которое сдвигается при изменении потенциала системы:
где Indox – окисленная, а IndRed – восстановленная формы индикатора; n – число электронов, принимающих участие при переходе молекулы индикатора из одной формы в другую.
Потенциал такой индикаторной системы может быть рассчитан по уравнению Нернста:
где Е 0 – стандартный электродный потенциал, возникающий в системе, когда молярные концентрации окисленной (с(Indox)) и восстановленной (с(IndRed)) форм индикатора будут равны друг другу.
Как и в случае индикаторов других типов, изменение окраски редокс-индикаторов происходит в некотором интервале изменения величины их электродного потенциала. Можно показать, что крайние значения этого интервала определяются соотношением:
Редокс-индикатор можно использовать в окислительно-восстановительном титровании, если его интервал перехода лежит внутри скачка редокс-потенциала системы на кривой титрования.
Редокс-индикаторы могут быть двухцветными (каждая из его форм имеет свою специфическую окраску) и одноцветными (табл. 22). В первом случае в точке эквивалентности мы наблюдаем переход одной окраски раствора в другую. Во втором случае – исчезновение или возникновение окраски титруемого раствора.
Таблица 22. Некоторые окислительно-восстановительные индикаторы
Способы определения точки эквивалентности
Процедура титрования всегда завершается нахождением точки эквивалентности и, по сути, сводится к измерению количества тит- ранта, прореагировавшего с определяемым веществом в эквивалентном соотношении. Следовательно, способ фиксирования точки эквивалентности в титриметрии имеет очень большое значение, поскольку от него будет зависеть точность полученных результатов анализа.
Физико-химические способы фиксирования точки эквивалентности. Если в процессе титрования с помощью соответствующих приборов измерять какое-либо физико-химическое свойство системы (величину тока, потенциал, электропроводность, оптическую плотность раствора и др.), то с изменением состава раствора в результате химической реакции будет происходить изменение свойств. Как правило, на графиках в координатах «физико-химическое свойство — объем добавленного титранта» точке эквивалентности соответствует наиболее резкое изменение свойств системы. Такие способы фиксирования точки экви вал ентости называют физико-химическими (в зависимости от измеряемого свойства градацию способов можно продолжить, например, как это представлено на рис. 4.3).
Визуальные способы фиксирования точки эквивалентности. При проведении химических реакций, в которых участвуют окрашенный титрант или окрашенное определяемое вещество, а продукты реакции бесцветны, о достижении точки эквивалентности в ходе титрования можно судить по изменению окраски раствора без применения каких-либо приборов. Например, в перманганато- метрии — по появлению розовой окраски титруемого раствора за счет избытка титранта (КМп04). Такой способ фиксирования называют визуальным безындикаторным. В том случае, если все участники и продукты реакции бесцветны (что наиболее характерно, например, для кислотно-основных реакций), для фиксирования точки эквивалентности необходимо использовать специальные вещества — индикаторы. Таким образом, точку эквивалентности в процессе титрования в химических методах анализа можно определить двумя способами:
Рис. 4.3. Общая классификация способов обнаружения точки эквивалентности при проведении титриметрических определений
Индикаторы — вещества, которые резко реагируют на изменение концентрации определяемого компонента или титранта вблизи точки эквивалентности. При этом они переходят в другую равновесную форму, изменяя окраску, люминесценцию или образуя осадок. Точка, в которой наблюдается резкое изменение окраски индикатора и заканчивается процесс титрования, называется конечной точкой титрования (КТТ).
Обычно индикаторы по своей природе идентичны либо определяемому веществу, либо титранту. Действие индикатора основано на смещении равновесия:
где х — продукт превращения индикатора, отражающий специфику реакции, в которой он участвует (табл. 4.1); Indp Ind2 — две сопряженные формы индикатора.
В зависимости от типа химической реакции используемые индикаторы подразделяют (см. табл. 4.1) на кислотно-основные, окислиТипы индикаторов
Типы реакций, лежащих в основе титрования
Метиловый оранжевый, фенолфталеин
Комплексообразования (в комплексонометрии)
Эриохром черный Т (ЭХЧТ), мурексид
тельно-восстановительные и металл-индикаторы, которые применяют при комплексонометрическом титровании.
При проведении реакций осаждения в качестве индикаторов обычно используют вещества, способные к образованию малорастворимых окрашенных соединений с титрантом или с определяемым веществом. Например, при титриметрическом определении хлоридов с помощью стандартного раствора нитрата серебра в качестве индикатора используют раствор дихромата калия. Пока в исходном растворе присутствуют хлорид-ионы, образуется белый осадок AgCl. После их полного осаждения первая избыточная капля титранта вызывает образование осадка Ag2Cr04, окрашенного в красный цвет, что сигнализирует о завершении процесса титрования.
Для описания свойств индикаторов рассмотрим реакцию (4.38), константа равновесия которой выражается уравнением
Возьмем отрицательный логарифм выражения (4.39) и, решив его относительно х, получим
или, заменив отрицательный логарифм (-lg) на р:
Обычно человеческий глаз способен улавливать изменение окраски, при которой концентрация одной формы индикатора больше другой в 10 раз, т.е. когда предельное отношение [Ind,]/[Ind2] = 10 : 1 или 1 : 10. Отсюда следует, что для каждого индикатора существует определенный интервал перехода окраски (Арх) с границами Арх = рКш ± 1 (вследствие того, что разные цвета воспринимаются по-разному, границы перехода окраски могут несколько отличаться от ±1). Лрх — интервал pH (для кислотно-основных индикаторов), интервал потенциалов (для редокс-индика- торов), либо интервал рМ(в случае металл-индикаторов), в пределах которого индикатор меняет окраску. Арх зависит от природы самого индикатора.
При обозначении интервала перехода окраски индикатора указывают две цифры значений измеряемого параметра, при которых отчетливо видна окраска форм Indj и Ind2. Кроме интервала перехода окраски, индикатор характеризуют также величиной рТ — показателем титрования индикатора. Показатель титрования — величина pH, потенциала либо рМ, при достижении которых происходит резкое изменение окраски индикатора и титрование заканчивается (достигается конечная точка титрования).
Рассмотрим свойства кислотно-основных индикаторов более подробно. Кислотно-основные индикаторы (Hind) — достаточно сильно окрашенные слабые органические кислоты или основания, у которых протонированная и депротонированная формы различаются по строению и окраске. Кислотно-основные индикаторы подразделяют на две группы: одноцветные (например, фенолфталеин) и двухцветные индикаторы (например, метиловый оранжевый).
Если кислотно-основные индикаторы представляют собой слабые кислоты (основания), то для них в водном растворе будет характерно следующее равновесие:
которое можно записать в упрощенной (4.42*) форме:
Равновесие (4.42*) можно охарактеризовать константой 
Поскольку при соотношении [HInd]/[Ind
] > 10 видна только окраска, соответствующая протонированной форме индикатора, а при соотношении [HInd]/[Ind
Указанный интервал носит название интервала перехода окраски индикатора АрН = рКш ± 1. Середина области перехода окраски индикатора — показатель титрования рТ=рКш (совпадает не во всех случаях), рТ — то его значение, при котором заканчивают титрование с данным индикатором. Если глаз улавливает переход окраски при меньших соотношениях [HInd]/[Ind _ ], то интервал перехода окраски сужается, тем более ценным является индикатор, поскольку точность определений при его использовании возрастает. В табл. 4.2 представлены свойства некоторых кислотно-основных индикаторов.
Свойства некоторых кислотно-основных индикаторов
рТФрКш, поскольку чувствительность восприятия желтого и красного цветов человеческим глазом различная.
Выбор индикатора для проведения кислотно-основного титрования осуществляется в соответствии со следующими положениями:
Аналогичным образом проводят выбор индикаторов других типов.
Способы приготовления титрантов Особое значение в титриметрии имеет приготовление титрантов — растворов с точной известной концентрацией, без чего использование метода титриметрии в количественном анализе невозможно.
Существуют следующие способы приготовления растворов с точно известной концентрацией.
Метод фиксаналов. Фиксаналы представляют собой запаянные стеклянные ампулы, содержащие определенную массу вещества. Для приготовления титранта ампулу фиксанала разбивают над воронкой с пробивным устройством и содержимое ее количественно переносят в мерную колбу (обычно объемом 1 л). Концентрация полученного раствора указывается на ампуле.
Приготовление растворов по точной навеске. При этом проводят растворение точно взвешенной массы чистого реагента в мерной колбе. Наиболее часто этот способ используют для приготовления растворов карбоната натрия, оксалата аммония, дихромата калия. Массу вещества рассчитывают по формуле
Вещество должно удовлетворять ряду требований:
а) быть химически чистым (содержание примесей не должно превышать 0,05%);
Приготовление раствора приблизительной концентрации с последующей стандартизацией — установлением его точной концентрации с помощью первичного или вторичного стандарта. Под первичным стандартом понимают стандартный раствор установочного вещества. Установочное вещество — вещество, с помощью которого устанавливают точную концентрацию титранта. В качестве установочных веществ можно использовать только те, которые удовлетворяют перечисленным выше требованиям. Кроме того, они должны реагировать с титрантом в соответствии с требованиями, предъявляемыми к реакциям в титриметрии. Вторичный стандарт — раствор, концентрация которого определена с использованием первичного стандарта. Таким способом готовят растворы хлороводородной кислоты, едкого натра, перманганата калия, йода.
Основные расчетные формулы титриметрии
Расчеты титриметрических определений основаны на использовании закона эквивалентов или эквивалентных соотношений:
Уравнение (4.45) можно выразить через молярную концентрацию эквивалента (с использованием формулы (4.12)):
Данное выражение называют основным уравнением титриметрии.
Зная молярную концентрацию эквивалента титранта — С — R ],
объем раствора, взятого для анализа, — V(X), и определив в результате титрования объем титранта, пошедший на реакцию с определяемым веществом, — V(R), можно с помощью уравнения (4.46) вычислить молярную концентрацию эквивалента определяемого вещества в анализируемом растворе:
Закон эквивалентов (уравнение (4.45)) можно выразить и через массу определяемого вещества:
где V(R) — объем титранта, пошедший на реакцию с определяемым веществом, мл; т(Х) — масса определяемого вещества (X), г;
М —X — молярная масса эквивалента определяемого вещества;
10 3 — коэффициент пересчета миллилитра в литр.
Решив последнее выражение относительно т(Х), получим вторую основную расчетную формулу титриметрии:
которую используют для вычисления массы определяемого вещества (в граммах) в растворе, взятом для анализа (метод отдельных навесок).
В том случае, если используется метод пипетирования (метод аликвотных частей) и титруется только часть пробы (аликвота), в расчетную формулу необходимо ввести коэффициент, учитывающий данный эффект:
где VM к — объем мерной колбы, в которой содержится вся проба; Vaл — объем аликвоты, которая отбирается с помощью пипетки (часть или доля раствора).
Например, для титрования взята аликвота (в переводе — равная доля) объемом 20,0 мл из раствора, содержащего всю анализируемую пробу в мерной колбе на 200 мл, тогда масса определяемого вещества в колбе будет в 10 раз больше, чем в аликвоте (Vu к/Кал = 200/20,0).
Способы обнаружения точки эквивалентности. Кислотно-основные индикаторы. Интервал перехода индикатора. Выбор индикатора. Ошибки титрования.
Способы фиксирования точки эквивалентности в методе кислотно-основного титрования основаны на использовании резкого изменения pH вблизи точки эквивалентности. Определить точку эквивалентности можно двумя способами 1) визуально (индикаторный способ) и 2) инструментально (потенциометрическое, кондуктометрическое, спектрофотометрическое и другие виды титрования). При визуальном определении применяют кислотно-основные индикаторы, представляющие собой слабые органические кислоты или основания, окраска которых изменяется при изменении pH среды.
Водородная- Недотитрованная сильная кислота сильным основанием (проба, в которой не достигнута точка эквивалентности и вещество пробы находится в избытке)
Гидроксидная— Недотитрованное сильное основание сильной кислотой
Перетитрованное сильное основание сильной кислотой (проба, в которой находится избыток титранта)
Перетитрованная сильная кислота сильным основанием
Поможем написать любую работу на аналогичную тему
Способы обнаружения точки эквивалентности. Кислотно-основные индикаторы. Интервал перехода индикатора. Выбор индикатора. Ошибки титрования.
Способы обнаружения точки эквивалентности. Кислотно-основные индикаторы. Интервал перехода индикатора. Выбор индикатора. Ошибки титрования.
Способы обнаружения точки эквивалентности. Кислотно-основные индикаторы. Интервал перехода индикатора. Выбор индикатора. Ошибки титрования.
Способы определения точки эквивалентности
В редоксиметрии точку эквивалентности можно определить с помощью различных инструментальных методов (например, потенциометрически) либо визуально.
Визуальное обнаружение конечной точки титрования может быть проведено по изменению окраски одного из участников протекающей реакции, либо с помощью индикаторов. Например, в перманганатометрии критерием достижения точки эквивалентности обычно служит появление неисчезающей розовой окраски вследствие добавления к бесцветному титруемому раствору одной лишней капли ярко-малинового раствора KМnO4.
Индикаторы, используемые для определения точки эквивалентности, могут быть специфическими либо окислительно-восстановительными.
Специфические индикаторы реагируют на изменение концентрации одного из участников химической реакции, протекающей при титровании, образуя с ним нестойкое яркоокрашенное соединение.
Оно легко может разрушаться при добавлении второго реагента. Например, в иодометрии для этих целей используют раствор крахмала, образующий с I2 соединение ярко-синего цвета. По исчезновении (в результате расходования I2) или возникновении (при добавлении лишней капли раствора I2) синей окраски судят о достижении точки эквивалентности.
Окислительно-восстановительными, или редокс-индикаторами, называются вещества, которые изменяют свою окраску в зависимости от величины окислительно-восстановительного потенциала системы.
Под действием окислителя или восстановителя в структуре молекулы редокс-индикатора происходят изменения, вызывающие возникновение новой окраски. Таким образом, в растворе редокс-индикатора существует равновесие между его окисленной и восстановленной формами, имеющими разную окраску, которое сдвигается при изменении потенциала системы:
где Indox – окисленная, а IndRed – восстановленная формы индикатора; n – число электронов, принимающих участие при переходе молекулы индикатора из одной формы в другую.
Потенциал такой индикаторной системы может быть рассчитан по уравнению Нернста:
где Е 0 – стандартный электродный потенциал, возникающий в системе, когда молярные концентрации окисленной (с(Indox)) и восстановленной (с(IndRed)) форм индикатора будут равны друг другу.
Как и в случае индикаторов других типов, изменение окраски редокс-индикаторов происходит в некотором интервале изменения величины их электродного потенциала. Можно показать, что крайние значения этого интервала определяются соотношением:
Редокс-индикатор можно использовать в окислительно-восстановительном титровании, если его интервал перехода лежит внутри скачка редокс-потенциала системы на кривой титрования.
Редокс-индикаторы могут быть двухцветными (каждая из его форм имеет свою специфическую окраску) и одноцветными (табл. 22). В первом случае в точке эквивалентности мы наблюдаем переход одной окраски раствора в другую. Во втором случае – исчезновение или возникновение окраски титруемого раствора.
Таблица 22. Некоторые окислительно-восстановительные индикаторы
Перманганатометрия
Перманганатометрическим титрованием называется титриметрический метод анализа, основанный на использовании в качестве титранта KМnO4.
Перманганатометрическое титрование проводят чаще всего в кислой среде, реже – в нейтральной. Щелочные растворы KМnO4 используют для количественного определения некоторых органических соединений: спиртов, альдегидов. Во всех трёх случаях продукт восстановления иона МnO4 – и редокс-потенциал системы различны:
а) МnO4 – + 8H + + 5ē = Mn 2+ + 4H2O,
Таким образом, в кислой среде, окислительная активность KМnO4 является самой высокой, что позволяет при этих условиях определить гораздо большее число различных восстановителей, чем в нейтральной и щелочной средах. Кроме того, при титровании в нейтральной и слабощелочной средах образуется тёмно-бурый осадок MnO2, сильно затрудняющий фиксирование точки эквивалентности.
Азотная кислота (особенно содержащая оксиды азота) сама является сильным окислителем и может, наряду с KМnO4, окислять определяемое вещество, что приведёт к получению заниженных результатов анализа. Соляная и другие галогеноводородные кислоты (HBr, HI) будут, наоборот, окисляться KМnO4:
Рабочий раствор KМnO4 по точной навеске кристаллического вещества приготовить невозможно, т.к. в нём всегда содержится некоторое количество MnO2.
Кроме того, MnO2 образуется при окислении органических соединений, присутствующих в окружающей среде, например в воздухе.
В водных растворах концентрация KМnO4 со временем уменьшается, так как перманганат калия частично расходуется на окисление различных посторонних примесей (присутствующих даже в дистиллированной H2O) и самой воды.
Данная реакция протекает достаточно медленно, поэтому правильно приготовленный раствор KМnO4 можно хранить в течение нескольких недель.
Обычно раствор KМnO4 готовят несколько больше заданной концентрации. Рассчитанную для этих целей навеску вещества взвешивают на технических весах.
Перед установлением точной концентрации раствор KМnO4 кипятят в течение небольшого промежутка времени (≈10 минут), а затем после охлаждения выдерживают в тёмной посуде несколько дней, чтобы завершились процессы окисления органических веществ и других примесей, содержащихся в H2O. После этого раствор фильтруют через стеклянный фильтр для удаления образовавшегося MnO2 и затем титруют рабочим раствором дигидрата щавелевой кислоты H2C2O4·2H2O или её натриевой соли Na2C2O4 (приготовленным по точной навеске вещества) в соответствии с уравнением:
Перегревать раствор H2C2O4 (тем более доводить его до кипения) нельзя, т.к. растворенное вещество при этом будет частично разрушаться:
H2C2O4 
Вместо нагревания к раствору щавелевой кислоты можно добавить определенное количество горячей H2O с таким расчётом, чтобы температура смеси стала равной приблизительно
60-80 о С.
Индикаторы в перманганатометрическом титровании обычно не используются. В их роли выступает раствор KМnO4, имеющий интенсивную фиолетовую окраску. Конечную точку титрования обнаруживают по исчезновению окраски раствора KМnO4 (если к нему прибавляют из бюретки исследуемый раствор) или, наоборот, появлению неисчезающей слабо-розовой окраски при добавлении одной лишней капли выступающего в роли титранта раствора KМnO4.
Не рекомендуется оставлять раствор KМnO4 в бюретках на длительное время.