Ткс черной субстанции что это
Транскраниальное УЗИ черной субстанции при болезни Паркинсона.
Обращаем Ваше внимание на то, что в соответствии с п. 10.ст.16 Федерального Закона «Об обязательном медицинском страховании» №326-ФЗ от 29.11.2010 года, при каждом обращении за медицинской помощью в ОКДЦ, вы должны предъявить свой полис ОМС в регистратуре центра.
Как узнать результаты исследований?
Уважаемые пациенты!
В приемном отделении ОКДЦ с 8.00 до 15.00 работает процедурный кабинет, где по назначению врача, на платной основе выполняются инъекции, включая:
-внутривенно-капельную инфузию,
-внутривенно-струйную инъекцию,
-внутримышечную инъекцию,
— подкожную инъекцию,
-премедикацию (обезболивание) перед проведением исследований МРТ. СКТ, коронарографии, ФГДС, ФКС и бронхоскопии.
Если Вы хотите получить эту медицинскую услугу, Вам необходимо обратиться в регистратуру ОКДЦ, имея при себе заключение Вашего лечащего врача и его рекомендации.
Уважаемые пациенты!
Запись на повторный прием проводится только через телефон Вашего лечащего врача ОКДЦ, информация об этом имеется в маршрутном листе.
На первичный прием Вы можете записаться самостоятельно через сайт или единый телефон Call-центра 8(863) 227-00-00
Уважаемые пациенты!
С целью предупреждения распространения вирусных инфекций, таких как грипп, ОРВИ, новый коронавирус 2019-nCoV, а так же ввиду отсутствия в ГАУ РО «ОКДЦ» врача-инфекциониста, пациентам с температурой, насморком, чиханием, кашлем, головной болью, болью в горле, рекомендовано обращаться к врачу-инфекционисту либо врачу-терапевту в медицинскую организацию по месту жительства.
Транскраниальная сонография черной субстанции (уникальная методика)
Черной субстанцией называется область среднего мозга, отвечающая за регуляцию движений. Наш центр одним из первых в РФ внедрил методику оценки изменения эхогенности ультразвукового сигнала от чёрной субстанции у пациентов с экстрапирамидными заболеваниями и, в частности, при болезни Паркинсона. Выявляемый феномен «гиперэхогенности» ножек среднего мозга является общепризнанным в мире биомаркером, характерным для болезни Паркинсона, который помогает неврологу поставить диагноз. Необходимо понимать, что данный признак не является 100% для болезни Паркинсона, поэтому окончательное заключение делает врач на основании всей информации о пациенте. Накопленный многолетний опыт (около 20 лет) изложен в уникальной монографии «Транскраниальная сонография при экстрапирамидных заболеваниях» и учебном пособии «Ультразвуковое исследование структур головного мозга при экстрапирамидной патологии».
*Показания к проведению исследования определяются неврологом!
Что исследуется?
Оценивается эхогенность сигнала от черной субстанции, размеры третьего и боковых желудочков головного мозга.
Подготовка
Специальной подготовки не требуется.
Обращаем внимание, что у 10-20% людей, особенно у лиц пожилого возраста, исследование провести невозможно из-за отсутствия ультразвуковых окон, поэтому сначала проводится исследование, а затем осуществляется оплата.
Транскраниальное ультразвуковое сканирование мозга при болезни Паркинсона
Опубликовано в журнале:
Визуализация в клинике »» N17, Декабрь 2000 TRANSCRANIAL ULTRASOUND SCANNING OF THE BRAIN IN PARKINSON’S DISEASE
А.О. Чечеткин
Chechetkin A.О.
Научно-исследовательский институт неврологии РАМН, Москва
Research Institute of Neurology, Russian Academy of Medical Sciences, Moscow
В обзоре дана оценка возможностей транскраниального ультразвукового сканирования (ТКУС) в выявлении структурных изменений головного мозга при болезни Паркинсона (БП). Показано, что у большинства больных БП выявляют повышение эхогенности ткани мозга в области черной субстанции (ЧС), а также расширение третьего желудочка. Однако наличие гиперэхогенного ультразвукового сигнала от области ЧС и размер его площади не являются специфическими признаками заболевания, так как схожие изменения выявлены и у лиц без клинических признаков БП. Роль ТКУС в диагностике БП остается неясной. Проведение дальнейших исследований с верификацией полученных ультразвуковых данных с помощью позитронно-эмиссионной томографии, возможно, поможет решить эту задачу.
The potentialities of transcranial ultrasound scanning (TCUS) in identification of structural changes of the brain in patients presenting with Parkinson’s disease (PD) are reviewed. It is demonstrated that the majority of PD patients show an increase of brain tissue echogenicity in the area of substantia nigra (SN) and an enlargement of the third ventricle. However, the presence of the hyperechogenic ultrasound signal from the SN region and the size of its area are not specific signs of the disease because the similar changes were also revealed in persons without the clinical evidence of PD. The role of TCUS in the diagnosis of PD remains unclear. Further studies including verification of the ultrasound data by positron emission tomography are likely to be of help in solving this problem. («Визуализация в клинике». 2000, 17. 45-48)
Ключевые слова: болезнь Паркинсона, транскраниальное ультразвуковое сканирование, черная субстанция.
Key words: Parkinson’s disease, transcranial ultrasound scanning, substantia nigra.
Диагностика болезни Паркинсона (БП) может представлять определенные трудности, особенно в дебюте заболевания. Для ее распознавания из визуализирующих методов исследования используют магнитно-резонансную томографию (МРТ) и позитронно-эмиссионную томографию (ПЭТ). МРТ головного мозга позволяет выявлять только неспецифические и едва уловимые изменения [4, 11, 18, 24]. Более точные сведения о нигростриарной системе позволяет получать ПЭТ, которая способствует ранней диагностике БП даже в доклинической стадии [9, 13, 15, 17, 19, 21]. Однако понятно, что такой дорогостоящий вид исследования не может быть использован как рутинный диагностический метод.
В последние годы возросла роль транскраниального ультразвукового дуплексного сканирования в диагностике церебральных заболеваний, которое позволяет визуализировать сосудистую систему и вещество головного мозга. Данные об использовании транскраниального ультразвукового сканирования (ТКУС) вещества мозга у больных БП немногочисленны и неоднозначны.
В 1995 г. Becker G. et аl. [5] впервые выполнили ТКУС мозга у больных БП. Поскольку этот метод позволяет визуализировать ткани головного мозга в зависимости от их эхогенности, авторы поставили перед собой задачу выяснить, можно ли с его помощью выявлять структурные изменения мозга при БП. Для этого они оценивали состояние области предполагаемого анатомического расположения черной субстанции (ЧС) на уровне ножек среднего мозга, проводя исследование через височное ультразвуковое окно. Авторы считали, что в норме ультразвуковой сигнал от ЧС идентичен эхогенности прилежащей ткани мозга.
При исследовании 30 больных БП и 30 лиц без клинических проявлений этого заболевания они получили следующие данные: у 17 больных и у 2 лиц контрольной группы было выявлено гомогенное повышение эхогенности ткани мозга в области ЧС. Следует отметить, что у 5 больных и двух лиц контрольной группы эти изменения определялись с трудом. Анализ полученных данных показал, что у больных с четкой гиперэхогенной зоной в области ЧС (12 пациентов, т.е. 40% от числа всех больных) клиническая симптоматика была более выражена, а доза антипаркинсонических препаратов оказалась выше, чем у больных с изоэхогенной ЧС (18 больных). Авторы предположили, что повышение эхогенности в области ЧС, по-видимому, обусловлено относительным увеличением глиальных клеток в сочетании с микроструктурными изменениями клеточной архитектоники, о чем сообщали Bogerts В. et аl. [8].
Сопоставление длительности заболевания с наличием выявленной зоны повышенной эхогенности в области ЧС дало противоречивые результаты. Becker G. et аl. [5] обнаружили гиперэхогенную зону в области ЧС примерно у половины больных БП и только при длительном течении заболевания (в среднем 14,6+/-4,5 лет), когда клинический диагноз уже не вызывал сомнения; в то же время у больных с изоэхогенной ЧС продолжительность заболевания составляла в среднем 6,5+/-4,2 года. В. Лелюк с соавт. [1, 16] наблюдали такие изменения абсолютно у всех больных независимо от длительности заболевания с момента появления первых симптомов.
Результаты измерения третьего желудочка свидетельствуют о его расширении у больных БП по сравнению с соответствующими данными в контрольных группах. Так, в работе Becker G. et аl. [5] и В. Лелюка с соавт. [1] размеры третьего желудочка у больных БП составляли в среднем 8,6+/-2,3 мм и 6,3+/-1,2 мм против 7,4+/-2,2 мм и 2,6+/-1,2 мм в контрольных группах соответственно. Авторы объясняют это атрофическими изменениями головного мозга у больных БП, описанными Schneider Е. et аl. [20].
Как указывалось выше, Becker G. et аl. [5] обнаружили гиперэхогенный сигнал у 2 лиц контрольной группы. Эти находки навели Berg D. et аl. [6] на мысль о проведении скринингового исследования эхогенности в области предполагаемого анатомического расположения ЧС у лиц без клинических проявлений БП. Они исследовали 301 человека (146 мужчин и 155 женщин) в возрасте до 79 лет (средний возраст около 30 лет). В число исследованных вошли здоровые добровольцы (студенты и сотрудники госпиталя), а также пациенты, страдающие грыжами межпозвоночного диска и невоспалительной миопатией. Поскольку сигнал эхогенности (яркости) в В-режиме не является количественным параметром, котур видимых гиперэхогенных изменений в области ЧС обводили, а затем определяли полученную площадь. Исследования выполнялись двумя независимыми специалистами. Полученные ими данные о зоне повышенной эхогенности в области ЧС суммировали, определяли средние значения и использовали их для дальнейшего анализа. В среднем площадь гиперэхогенного сигнала с одной или с обеих сторон у исследованных лиц составляла 0,11 см2 при этом наблюдалась четкая закономерность повышения полученных значений с возрастом. Была выделена группа из 26 человек (16 мужчин и 10 женщин) с более широкой зоной гиперэхогенного сигнала, площадь которой с одной или с обеих сторон превышала 0,25 см2. Численность этой группы составила 8,6% от числа включенных в исследование лиц. Площадь гиперэхогеиного сигнала справа и слева была равна у них в среднем 0,32 см2. Для более детального исследования отобрали по 10 человек, сопоставимых по полу и возрасту, из обследованных с площадью гиперэхогенного сигнала менее 0,2 см2 (первая группа) и из пациентов с площадью, превышающей 0,25 см2 (вторая группа). У них было проведено исследование двигательных функций (использование доски со штифтами и серия тестов с применением печатной машинки), когнитивных функций (стандартизированный психометрический тест) и МРТ. ПЭТ выполнили только у лиц второй группы, и для сравнения полученных данных отобрали 10 человек из числа ранее обследованных в клинике больных без БП, которым вводили [18F]-dopa. Были получены следующие результаты: 1) тесты по оценке двигательных функций не показали статистически значимых различий между двумя группами; 2) при оценке когнитивных функций выявлены значительные различия только в плавности речи, которая была хуже во второй группе; 3) относительные интенсивности сигналов от ЧС при МРТ были повышены у лиц второй группы; 4) обнаруженные при ПЭТ соотношения активности внутривенно введенной [18F]-dopa в базальных ганглиях во второй группе были значительно ниже, чем в группе лиц, взятых для сравнения. Несмотря на полученную корреляцию данных ультразвукового исследования, МРТ и ПЭТ, природа гиперэхогенного сигнала от области ЧС осталась для авторов неясной. Ими высказано предположение, что у лиц второй группы нигростриарная система более уязвима по отношению к различным патогенетическим факторам (экзо- и эндотоксинам), под воздействием которых может произойти нейрональная дегенерация ЧС, о чем сообщали другие авторы [14, 23]. На наш взгляд, это высказывание является гипотетическим, так как подтвердить происходящие изменения в области ЧС могут только патоморфологические, гистохимические и электронно-микроскопические исследования.
Любопытные результаты получены при сопоставлении площади гиперэхогенной зоны в области ЧС у больных БП и у лиц без клинических симптомов этого заболевания. Так, в работе В. Лелюка с соавт. [1] у больных БП она была практически равна площади гиперэхогенной зоны той же области у лиц без клинических признаков БП, найденной Berg D. et аl. [6], и составляла примерно 0,32 см2. Эти находки позволяют считать, что получение сигнала повышенной эхогенности и размер его площади не являются специфическими признаками БП.
В работе Berg D. et аl. [6] показано, что гиперэхогенный сигнал площадью более 0,25 см2 в области ЧС встречался у 8,6% от общего числа исследованных. Однако эти результаты существенно превышают данные о частоте встречаемости БП в популяции, которая, по данным Golbe L. [12], составляет 0,1%, а по данным других авторов [2], колеблется от 60 до 140 случаев на 100000 населения, что составляет соответственно 0,06 и 0,14%.
Исходя из изложенного выше, можно отметить, что у больных БП методом ТКУС в большинстве случаев выявляются повышение эхогенности ткани мозга в области предполагаемого анатомического расположения ЧС и расширение третьего желудочка по сравнению с контрольной группой. Однако данные о частоте обнаруженных изменений в области ЧС у больных БП, а также о связи между длительностью заболевания и их наличием противоречивы. Кроме того, в работах, где больным БП было проведено ТКУС, для верификации полученных данных не была произведена ПЭТ, которая, в отличие от МРТ, в настоящий момент является наиболее информативной методикой в диагностике этого заболевания.
Наличие зоны повышенной эхогенности в области ЧС при ТКУС не является специфическим признаком для БП, поскольку она обнаруживается не у всех больных БП и такие же изменения находят и у лиц без клинических проявлений этого заболевания. Размер площади гиперэхогенного ультразвукового сигнала также не может служить диагностическим критерием, так как у больных БП, как показано выше, он был практически идентичен размеру исследуемой зоны у лиц без БП.
Следует отметить, что визуализация структур головного мозга при ультразвуковом исследовании в В-режиме в значительной степени зависит от ультразвукового окна, а оценка видимых изменений весьма субъективна (особенно в отношении измеряемой площади), так как сигнал эхогенности (яркости) не является количественным параметром.
Таким образом, роль ТКУС в диагностике БП остается неясной. Проведение дальнейших исследований с верификацией полученных ультразвуковых данных с помощью ПЭТ, возможно, поможет решить эту задачу.
Общество
Возможности транскраниальной сонографии в диагностике экстрапирамидных заболеваний
Болезнь Паркинсона (БП) является вторым по частоте нейродегенеративным заболеванием человека, которое встречается с частотой 150-250 случаев на 100 тыс. населения, или в 2—4% среди лиц старше 65 лет. Согласно данным ВОЗ, общее число больных болезнью Паркинсона в мире составляет около 3,7 млн., ежегодно регистрируется свыше 300 тыс. новых случаев болезни [4, 27, 58]. Предполагается, что в ближайшие 25 лет число людей, страдающих БП, может удвоиться и привести к значительному увеличению экономических затрат национальных систем здравоохранения и семей пациентов. Это ставит БП в разряд не только медицинских, но и социально-экономических проблем [58].
Сложность дифференциальной диагностики БП (особенно в дебюте болезни), а также необходимость диагностики доклинических стадий требуют поиска информативных инструментальных методов исследования. В последние годы в этой связи все больше внимания уделяется ультразвуковому исследованию (УЗ) структур головного мозга — транскраниальной сонографии (ТКС).
В 1995 г. G. Becker et al. было опубликовано первое описание применения ТКС у пациентов с БП [6]. В работе был выявлен характерный для БП феномен — гиперэхогенность черной субстанции (ГЧС). Это сообщение поначалу встретило значительный скептицизм в научном обществе, так как метод считается достаточно субъективным и, кроме того, на тот момент другие нейровизуализационные методы не находили каких-либо применений при БП [2, 5, 12]. Однако практика последнего десятилетия не только показала, что феномен ГЧС является основным, наиболее надежным и воспроизводимым, УЗ-биомарке-ром БП на всех стадиях заболевания, но и убедительно продемонстрировала расширение сферы диагностического применения ТКС при других экстрапирамидных расстройствах, что помогло раскрыть новые аспекты их патогенеза [5, 10, 12,50].
Физические принципы ТКС, основанные на отражении УЗ-волн от неоднородных структур, обладающих различным акустическим сопротивлением (В-режим), позволяют выявлять характерные изменения черной субстанции, шва мозга, базальных ганглиев, ядер мозжечка, которые невозможно определить иными нейровизуализационными методами с другими физическими принципами получения изображения [5, 12, 37].
Преимуществами метода ТКС являются неинвазивность, широкая доступность в клинической практике, короткое время и относительно невысокая стоимость исследования, возможность проведения неограниченного количества исследований без риска для здоровья пациента. Кроме того, ТКС не зависит от двигательной активности пациентов, что особенно важно для больных с экстрапирамидными расстройствами и с гиперкинетической активностью [12, 50]. В связи с этим ТКС представляется перспективным инструментальным методом для скрининга и рутинной диагностики заболеваний.
Однако методика имеет определенные ограничения, основным из которых является зависимость от качества височного УЗ-окна: у некоторых обследуемых по причине ограничения проникновения УЗ-лучей через костный барьер получаемые изображения не позволяют с уверенностью оценить структуры головного мозга. Так у 5—10% людей европеоидной расы невозможна оценка структур среднего мозга, а в 10-20% — базальных ганглиев; у людей азиатского происхождения акустическое окно отсутствует в 15—60% случаев [12, 50]. Факторами, ассоциированными с отсутствием височных ультразвуковых окон, являются пожилой возраст и женский пол, что, возможно, связано с процессами гиперостоза и остеопороза, изменяющими акустическую характеристику костей черепа [3].
Качество получаемых изображений также напрямую зависит от класса УЗ-прибора. Для детальной визуализации небольших структур головного мозга необходимы системы последнего поколения (экспертного класса), позволяющие получать серошкальные изображения высокого разрешения. Кроме того, методика проведения ТКС и интерпретация результатов зависят от квалификации специалиста, проводящего исследование [11, 12, 50].
Методика ТКС
Для качественной и количественной оценки структур головного мозга используется В-режим. В некоторых случаях для улучшения контрастности, разрешения изображения и сокращения время поиска исследуемых структур используется режим второй тканевой гармоники (с подавлением основного эхосигнала и усилением амплитуды второго отраженного эхосигнала). Однако идентифицированные структуры оцениваются только в В-режиме [37].
Исследование выполняется через транстемпоральный доступ при расположении датчика в преаурикулярной области. Структуры ствола мозга, базальные ганглии и желудочки визуализируются в трех стандартизированных плоскостях сканирования. Для этих плоскостей разработаны четкие УЗ-ориентиры и определены углы наклона датчика (рис. 1-3). Для визуализации структур мозга используется фазированный датчик с частотой 2,5 МГц. Устанавливается глубина 140-160 мм, динамический диапазон 45-50 dB. Яркость и контрастность выставляются индивидуально для каждого конкретного случая [5, 11, 12, 50].

Для единообразия использования терминов в разработанных рекомендациях дано определение понятия гиперэхогенности. Структура описывается как гиперэхогенная в случае, если интенсивность УЗ-сигнала превышает таковую от окружающих областей. Термин «гиперэхогенность» применяется также, когда измеренная площадь гиперэхо-генной структуры превышает нормальные значенмя, полученные в популяционных исследованиях [11, 12, 50].
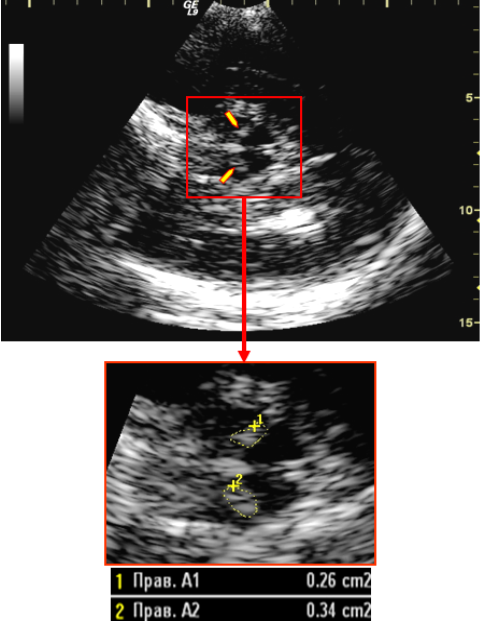
По значению площади черной субстанции в большинстве исследований принято бинарное деление ее гиперэхогенности с пороговым значением 20 мм 2 : эхогенность черной субстанции считается повышенной, если площадь ее гиперэхо-генного сигнала превышает 20 мм 2 (5, 17, 34, 48|. Иногда выделяют три категории: нормальная гиперэхогенность (при значениях меньше 20 мм 2 ), значительная гиперэхогенность (при значениях равных или превышающих 25 мм;) и средняя гиперэхогенность (при значениях от 20 до 25 мм 2 ) [48,50,57].
При сканировании в плоскости среднего мозга необходимо помнить об артефактах, которые не должны быть включены в область измерения. К их числу относят пенет-рирующие артерии, имеющие гиперэхогенный сигнал, а также реверберации эха от базальных цистерн, окружающих средний мозг |11, 12, 50].
Красные ядра обычно визуализируются в виде небольших белых округлых структур, расположенных около средней линии среднего мозга, дорзальнее черной субстанции, и сравнимых по эхогенности с базальными цистернами. В редких случаях бывает сложно разграничить черную субстанцию и красные ядра. Полуколичественной оценки эхогенности красных ядер не разработано, и до настоящего времени гипоэхогенность красных ядер не рассматривается как явление патологическое.
Эхогенность шва мозга оценивается в сравнении с гипер-эхогенными красными ядрами или с базальными цистернами. Его проекцию следует исследовать с обеих сторон. Обычно эхогенность шва идентична эхогенности красных ядер и представлена относительно ровной линией. Эхогенность шва мозга признается низкой, если линия прерывается или не определяется вовсе [5, 12, 50].
Визуализация плоскости таламусов достигается путем наклона датчика вверх под углом в 10° к плоскости среднего мозга (рис. 2). В плоскости таламусов оценивают наибольший поперечный размер третьего желудочка и переднего рога контралатерального бокового желудочка. Для более точной и воспроизводимой оценки его ширины измерение производят от ипсилатеральной к контралатеральной стенке по внутреннему краю гиперэхогенной эпендимы. Предложена возраст-зависимая оценка ширины третьего желудочка: при возрасте от 20 до 60 лет нормальными считаются значения, не превышающие 7 мм, при возрасте 60 лет и — не превышающие 10 мм. В ряде исследований возрастное деление не проводилось [21, 52, 53].
Плученные при ТКС размеры третьего желудочка сопоставимы с размерами, полученными с помощью КТ и МРТ. Кроме третьего желудочка на данном уровне оценивается эхогенность контралатерального лентикулярного и хвостатого ядер. Обычно эти структуры той же эхогенности, что и окружающие их области, иногда лентикулярное ядро может визуализироваться, как точкообразное или размытое гиперэхогенное образование (рис. 5). Возможна количественная оценка площади этих структур, подобно той, которая применяется для черной субстанции, главным образом, это актуально для лентикулярных ядер [5, 12, 50].
Третья плоскость сканирования — центральная часть контрлатерального бокового желудочка, которая достигается наклоном датчика вверх под углом в 25° к плоскости сканирования среднего мозга (рис. 3). Ширина бокового желудочка также оценивается количественно. Желудочек считается расширенным, если его ширина превышают 19 мм в возрасте от 20 до 60 лет и 22 мм — в возрасте 60 лет и старше.
Кроме перечисленных трех плоскостей сканирования при ТКС исследуются структуры задней черепной ямки в так называемой плоскости мозжечка. Структуры визуализируются путем поворота датчика на 45° (обращенная вперед сторона датчика поворачивается вверх) и наклоном его вверх на 10-15°, при этом настройки изображения сохраняются прежними. Паренхима мозжечка и его борозды могут определяться у здоровых лиц. У пациентов же со спи-ноцеребеллярой атаксией белое вещество мозжечка и зубчатые ядра выглядят более гиперэхогенными. В этой плоскости может визуализировать четвертый желудочек: у здоровых лиц в виде небольшой запятой, а при атрофических изменениях — в виде круглой гипо- или анэхогенной структуры. Гиперэхогенные зубчатые ядра, если они визу-лизируются, локализованы билатерально по отношению к гипоэхогенному четвертому желудочку [11, 12, 30, 35, 50].
ТКС при БП
ТКС состоялась как метод, главным образом, за счет выявления характерной для БП гиперэхогенности в области черной субстанции. Многочисленные независимые исследования, в том числе с дизайном слепых исследований, показали, что ГЧС выявляется более чем в 90% случаев при БП, тогда как в контрольной группе гиперэхоген-ность наблюдается достаточно редко — около 10% случаев [6,7,11,12,34,57].
Известно, что БП, проявляясь гипокинезией, ригидностью, тремором покоя и постуральной неустойчивостью, связана с постепенной нейродегенерацией нейронов черной субстанции [4, 58]. При этом манифестация моторных нарушений БП знаменует собой гибель более 70% ниграль-ных нейронов и снижение уровня дофамина в стриатуме более чем на 80% [19, 27, 46]. Показано, что на стадии манифестации БП ГЧС не связана с длительностью и тяжестью клинической картины, а также не зависит от формы заболевания. Гиперэхогенность не коррелирует с состоянием пресинаптических окончаний в стриатуме по данным ПЭТ и ОФЭКТ [12, 42]. По данным пятилетнего проспективного исследования ГЧС не отражает прогресси-рования и не меняется в процессе заболевания [14]. На основании этих клинико-ультразвуковых сопоставлений можно сделать вывод: ГЧС не столько отражает продолжающийся нейродегенеративный процесс при БП, сколько является универсальным и стабильным маркером определенного «нигрального неблагополучия» — особого физико-химического состояния черной субстанции среднего мозга [12, 50].
Причины гиперэхогенности черной субстанции окончательно не известны. Считается, что ГЧС отражает повышенное содержание железа, что подтверждается экспериментальными работами на животных, посмертными исследованиями человека, а также данными специального режима МРТ, способного к детекции железа [7, 9, 15]. Кроме того, ряд исследований выявил взаимосвязь ГЧС с уровнем ферритина и обратную взаимосвязь с уровнем нейромеланина в черной субстанции [59, 60]. У единичных пациентов с БП и ГЧС выявлены полиморфизмы в генах, участвующих в метаболизме железа, однако ни один из известных на сегодняшний день генов, ассоциированных с БП, напрямую не участвует в метаболизме железа [38].
Железо — самый распространенный металл переменной валентности в организме, что отражает важность данного элемента в метаболизме и функционировании клеток и одновременно является фактором, усугубляющим патологические процессы. Содержание железа в физиологических условиях в черной субстанции и в базальных ганглиях выше, чем в других областях головного мозга, и даже превышает таковое в печени — главном депо железа. В условиях БП концентрация железа в черной субстанции возрастает дополнительно на 35%, при этом изменяется соотношение Fe3+ : Fe2+ с 2 : 1 до 1 : 2. В свою очередь повышение уровня Fe2+ приводит к увеличению продукции свободных радикалов через реакцию Фентона, а, следовательно, к окислительному стрессу и нарушению нормального функционирования нигральных нейронов [7, 13, 24].
Пока еще не вполне понятно, на каком этапе патологического каскада происходит накопление железа. Однако показано, что присутствие железа, катализирующего свободнорадикальные реакции в клетке, способствует олигомеризации α-синуклеина и образованию из него протофибрилл, которые признаются основным эффектором патогенеза и главным компонентом телец Леви, патогно-моничных для этой нозологии. Железо может способствовать агрегации и инактивации паркина — мультифункцио-нального нейропротектора нейронов [13]. Кроме того, повышенный уровень железа нарушает баланс антиоксидантных и прооксидантных свойств нейромеланина — одного из нейрональных депо железа [22, 24, 60]. Несмотря на кажущуюся очевидность и простоту объяснения патогенеза БП с помощью «сидероза» черной субстанции, до сегодняшнего дня нет доказательств того, что именно нарушение метаболизма железа является первопричиной нейродегенерации [13].
БП является мультифакторным заболеванием, в этиологию которого вносят вклад несколько составляющих, среди них генетическая предрасположенность, факторы окружающей среды и возрастные изменения [1, 4, 58]. На сегодняшний день идентифицировано 16 генетических локусов, ассоциированных с развитием так называемых моногенных форм паркинсонизма и обозначаемых акронимом PARK [1, 32]. Моногенные формы являются патогенетически более гомогенными группами по сравнению с идиопа-тической БП, что позволяет проводить сопоставления определенных патогенетических механизмов с паттернами нейровизуализационных изменений. Кроме того, исследование асимптомных носителей мутаций, представляющих группу риска развития БП и определенную модель доклинических стадий заболевания, позволяет оценивать прогностические способности метода. Выявление группы риска является первоочередной задачей при изучении эффективности нейропротективных вмешательств при БП [25,36,43].
В проведенных работах практически у всех симптомных носителей мутаций моногенных форм паркинсонизма при ТКС выявлялся феномен ГЧС, однако гиперэхогенность по значениям площади несколько уступала ГЧС при идио-патической БП. Возможно, что при идиопатической БП железо-опосредованные нарушения играют в патогенезе более значимую роль, чем при моногенном паркинсонизме, при котором нарушение метаболизма железа выступает в качестве вторичного феномена по отношению к генетическому дефекту и усугубляет патологическое процессы через свободнорадикальное окисление [12, 40].
В работе по исследованию РАЯК2-формы паркинсонизма у асимптомных носителей только в части случаев выявлялась ГЧС, и именно у них при ПЭТ регистрировался дофа-минергический дефицит, тогда как у асимптомных носителей без ГЧС данные ПЭТ были в пределах нормальных значений [26, 55]. Полученные данные дают основания предполагать, что ГЧС может использоваться в качестве доклинического маркера заболевания.
Существуют и другие доказательства того, что ГЧС может выступать как биомаркер предрасположенности к БП. Так, в группе риска с отягощенным семейным анамнезом среди клинически здоровых родственников больных БП ГЧС выявлялась значительно чаще, чем в группе без подобного семейного анамнеза [39]. У клинически здоровых лиц с ГЧС значительно чаще выявлялись определенные стигмы, свидетельствующие о предрасположенности к развитию БП: функциональная несостоятельность нигростриарной системы по данным ПЭТ и ОФЭКТ; признаки замедленности моторики, усиливающиеся с возрастом; более высокий риск появления экстрапирамидных нарушений при приеме нейролептиков; гипосмия; депрессия и др. [7, 12,16,17,18, 41, 50]. Однако для окончательного утверждения ГЧС в качестве фактора риска БП необходимы длительные проспективные исследования, которые на сегодняшний день только начинают проводить [10].
ТКС при других экстрапирамидных заболеваниях
Растущий интерес к ТКС связан также с возможностями этого метода в дифференциальной диагностике БП с фенотипически сходными нозологическими формами [4, 46, 58]. Постановка диагноза «БП» отнюдь не простая задача, для этого должны быть исключены атипичные синдромы паркинсонизма, вторичный паркинсонизм, эссенциальный тремор, ряд других заболеваний.
С помощью ТКС можно выявить расширение желудочковой системы, а, следовательно, диагностировать нормотензивную гидроцефалию, в клиническую картину которой входит синдром паркинсонизма [12, 50]. Патологическая гиперэхогенность базальных ганглиев в результате кальцификации или аккумуляции тяжелых металлов особенно важна для диагностики таких заболеваний, как болезнь Вильсона-Коновалова, болезнь Фара, марганцевый паркинсонизм [12, 51]. При этих заболеваниях ТКС считается даже более значимым методом, чем КТ или МРТ, так как позволяет раньше визуализировать кальцификацию и отложения металлов. ТКС не способна распознать небольшие сосудистые очаги и посттравматические изменения, однако при сосудистом и посттравматическом паркинсонизме обычно не выявляется феномен ГЧС, что может помочь в постановке правильного диагноза [28, 47].
Клинические проявления атипичных синдромов паркинсонизма, особенно на начальных стадиях, не позволяют с уверенностью отличать эти случаи от БП [4, 33, 58]. В нескольких работах исследовались возможности ТКС в диагностике наиболее распространенных атипичных синдромов паркинсонизма — мультисистемной атрофии (МСА) и прогрессирующего надъядерного паралича (ПНП) [8, 23, 48, 49, 52]. Было показано, что ГЧС достаточно редко выявляется при МСА, а при ПНП — только в трети случаев. Кроме того, гиперэхогенность лентикулярных ядер также может помочь в постановке диагноза МСА и ПНП, тогда как для БП гиперэхогенность лентикулярных ядер не характерна [12, 21, 50]. Так, комбинация нормальной эхогенности черной субстанции с гиперэхогенностью лентикулярных ядер с высокой чувствительностью и специфичностью может дифференцировать МСА и ПНП от БП (прогностическая ценность положительного результата составляет 0,96) [23, 12]. В литературе описаны единичные случаи применения ТКС при кортикобазальной дегенерации и деменции с тельцами Леви, которые пока не позволяют сделать однозначных выводов касательно этих нозологии [53].
Как уже было отмечено, БП очень часто приходится дифференцировать с другим наиболее распространенным возраст-зависимым экстрапирамидным заболеванием — эссенциальным тремором. Результаты ТКС, а именно отсутствие феномена ГЧС, позволяют дифференцировать эссенциальный тремор и БП приблизительно в 85-90% случаях [20, 44, 45].
Описан опыт применения ТКС в диагностике депрессии, при которой в 50-70% случаев выявляется гипоэхогенность шва мозга. У пациентов с БП и с депрессией гипоэ-хогеность шва выявляется в 40-60% [5, 54, 56]. Также гипоэхогенность шва ассоциируется с другим немоторным проявлением БП — нарушением мочеиспускания [56]. Гиперэхогенность хвостатого ядра ассоциирована с психическими нарушениями при БП, дилятация переднего рога бокового желудочка более 20 мм — с деменцией [56].
Ряд сообщений посвящен применению ТКС при других экстрапирамидных заболеваниях [5, 29, 30, 31]. При идио-патической цервикальной дистонии гиперэхогенность лентикулярных ядер выявляется более чем в 75% случаев [5, 12]. При болезни Вильсона-Коновалова степень гипер-эхогенности лентикулярных ядер коррелирует с тяжестью неврологической симптоматики [11, 12]. Отдельные сообщения посвящены применению ТКС в диагностике хореи Гентингтона: у этих больных ширина третьего желудочка коррелирует со степенью когнитивных нарушений, присутствие ГЧС — с количеством тандемных CAG-повторов [5, 29]. При СЦА 2-го, 3-го и 17-го типов часто выявляется ГЧС как отражение вовлечения в патологический процесс черной субстанции, а для СЦАЗ характерен расширенный четвертый желудочек и гиперэхогенность зубчатых ядер [30, 35].
Таким образом, за последние 10-15 лет технология ТКС стала одной из наиболее перспективных и востребованных в диагностике различных экстрапирамидных заболеваний, однако сфера ее применения и диагностические алгоритмы требуют дальнейших исследований и уточнений. Нами накоплен собственный, в настоящий момент самый значительный в России, опыт использования ТКС в диагностике БП.
В работе рассмотрены основные значимые УЗ-маркеры, вычислены их референсные значения и предложены УЗ-критерии дифференциальной диагностики БП с фенотипически сходными заболеваниями.
Результаты и обсуждение
Всего с помощью транскраниальной сонографии нами было обследовано четыре группы пациентов: группу 1 составили пациенты с БП, группу 2 — с атипичным паркинсонизмом, группу 3 — с эссенциальным тремором и группу 4 (контрольную) — неврологически здоровые лица.
В основную группу вошли 100 пациентов с БП (диагноз установлен согласно общепринятым критериям [27]). Возраст на момент обследования составил 56 + 11,7 лет, соотношение мужчин и женщин — 40 : 60, длительность заболевания — 7,1 ±5,1 лет. Тяжесть состояния, оцениваемая в «оff»-периоде по унифицированной рейтинговой шкале Bn(UPDRS) — 41,3 ± 18 баллов.
В группу пациентов с атипичным паркинсонизмом вошли 14 больных: десять с мультисистемной атрофией и четыре — с прогрессирующим надъядерным параличем. Соотношение мужчин и женщин в группе составило 5 : 9; средней возраст — 61,4 + 7,6 лет.
Группу больных с эссенциальным тремором составили 39 пациентов; соотношение мужчин и женщин в этой группы было 13 : 26, средний возраст — 56,3 + 17,4 лет.
В контрольную группу вошли 56 человек, не страдающих экстрапирамидными заболеваниями и с удовлетворительными УЗ-окнами для проведения ТКС; соотношение мужчин и женщин — 32 : 24, средний возраст — 55,1 ±9,1 лет.
Сформированные группы сравнения были сопоставимы по полу и возрасту с основной группой БП.
ТКС выполняли на ультразвуковом сканере «Logiq 9» фирмы «GE» (США) с использованием фазированного секторного датчика с частотой 2,5 МГц по стандартной методике, описанной выше. При этом в каждом случае оценивалась площадь ГЧС (из двух значений справа-слева выбирали максимальное), наличие гиперэхогенности лен-тикулярных ядер (достаточным считалось одностороннее обнаружение), ширина третьего желудочка, а также ширина тела бокового желудочка (из двух значений справа-слева выбиралось максимальное).
Таблица 1. Ультразвуковые характеристики обследованных групп.
Контрольная
группа
(n = 56)
Атипичный
паркинсонизм
(n = 13)
тремор
(n = 37)
В группе атипичного паркинсонизма у одного больного с мультисистемной атрофией не оказалось УЗ-окон для проведения ТКС. Группа статистически значимо отличалась от группы БП меньшей частотой встречаемости ГЧС, расширенным третьим и боковыми желудочками. Указанные группы не различались по частоте встречаемости гиперэхогенности лентикулярных ядер. При рассмотрении отдельных нозологических форм с помощью логистического регрессионного анализа оказалось, что мультисистемная атрофия отличалась от БП отсутствием феномена ГЧС и расширением боковых желудочков с чувствительностью 83,3% и специфичностью 90,7%. Прогрессирующий надъ-ядерный паралич отличался от БП расширенными боковыми желудочками с чувствительностью 75% и специфичностью 93%.
В группе эссенциального тремора невозможно было оценить интракраниальные структуры по причине неудовлетворительных УЗ-окон у двух пациентов. Эта группа не отличалась от БП по ширине третьего, бокового желудочков и по частоте встречаемости гиперэхогенности лентикулярных ядер. В то же время частота встречаемости ГЧС при эссенциальном треморе была статистически значимо ниже, по сравнению с БП. Отсутствие ГЧС позволяет дифференцировать эссенциальный тремор от БП с чувствительностью 89,2% и специфичностью 90,9%.
Полученные данные еще раз подтверждают значимость ГЧС в диагностике БП, которая в нашей работе выявлена в 91% случаев заболевания и только в 14% среди лиц контрольной группы. Вычисленные пороговые значения могут использоваться как ориентировочные при проведении ТКС: таким разграничительным значением для площади ГЧС является величина 20 мм2, для третьего желудочка — 8 мм и центральной части бокового желудочка — 20 мм. С помощью ТКС с высокой чувствительностью и специфичностью могут быть дифференцированы от БП синдромы атипичного паркинсонизма и эссенциальный тремор: МСА — на основании отсутствия ГЧС и расширенных боковых желудочков, ПНП — на основании расширенных боковых желудочков, эссенциальный тремор — на основании отсутствия ГЧС. Расширение желудочковой системы при синдромах атипичного паркинсонизма закономерно отражает более обширное мультиструктур-ное поражение по сравнению с достаточно локальным патологическим процессом при БП, а нормальная эхоген-ность черной субстанции указывает на отличные от БП патогенетические механизмы развития этих заболеваний.
Наши данные несколько расходятся с литературными по такому параметру, как встречаемость гиперэхогенности лентикулярных ядер. Это можно объяснить большей субъективностью в оценке данного УЗ-феномена (наличие или отсутствие гиперэхогенности), а также малочисленностью обследованных нозологических подгрупп, что связано с редкостью этих заболеваний.
Таким образом, анализ литературы и наш собственный опыт позволяют заключить, что ТКС по своим техническим преимуществам и диагностическому потенциалу представляется одним из наиболее перспективных методов исследования экстрапирамидных заболеваний.
ЛИТЕРАТУРА
Автор: Федотова Е.Ю., Чечеткин А.О., Иллариошкин С.Н.
Информация предназначена исключительно для специалистов здравоохранения и не должна быть использована в качестве советов или рекомендаций по лечению

