почему нельзя ацц при ковиде
АЦЦ при коронавирусе: можно ли АЦЦ лонг при ковиде или нет? Как принимать?
АЦЦ при коронавирусе COVID-19 показан при наличии кашля с вязкой мокротой для облегчения ее выделения. Препарат имеет также и противовоспалительное, защитное действие на дыхательные пути, повышает эффективность применения противовирусных и антибактериальных средств.
Суточные дозировки для детей с 2 до 6 лет 300 мг, с 6 до 14 лет 400 мг, с 14 лет и взрослым 600 мг. АЦЦ противопоказан при язвенной болезни, легочном кровотечении, беременности, лактации. Чаще всего хорошо переносится, редко бывают кожные реакции, при их появлении нужно отменить медикамент.
В каких случаях назначают АЦЦ при коронавирусе
АЦЦ при коронавирусе COVID-19 назначается при наличии вязкой и трудноотделяемой мокроты. Он показан для облегчения влажного кашля (бывает у 33% пациентов) при легком течении болезни и средней тяжести.
При тяжелой форме коронавирусной пневмонии АЦЦ может использоваться после присоединения бактериальной инфекции, которая обычно протекает с обильным образованием мокроты. Препарат для разжижения слизи может применяться внутрь и для ингаляций через небулайзер для больных, находящихся на неинвазивной вентиляции легких (подача кислорода через маску).
Действие АЦЦ при коронавирусной инфекции
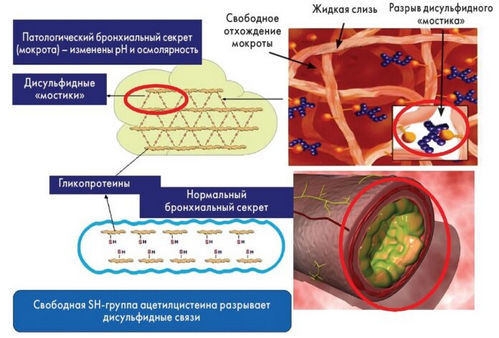
АЦЦ при коронавирусе используется в качестве симптоматического средства – для облегчения кашля путем снижения вязкости мокроты. Его механизм действия основан на:
Как пить АЦЦ при коронавирусе и АЦЦ Лонг для лечения взрослых и детей
АЦЦ при коронавирусе COVID-19 назначается с двух лет, детям до 6 лет в сутки можно принимать 300 мг, с 6 до 14 лет – 400 мг, взрослым назначают 600 мг. Так как АЦЦ. Лонг содержит в одной таблетке 600 мг, то его можно пить только взрослым. Для ребенка используют пакетики, шипучие таблетки по 100 мг или сироп, содержащий в 1 мл 20 мг ацетилцистеина. Их добавляют в 100 мл воды и принимают свежеприготовленным через 15 минут после еды.
Взрослому лучше выбрать пакетики или шипучие таблетки по 200 мг, АЦЦ Лонг или АЦЦ Актив по 600 мг. Для растворения нужен полный стакан воды. Для лучшего отхождения мокроты и очищения дыхательных путей рекомендуется увеличивать употребление теплой питьевой воды в 1,5-2 раза. Прием медикамента проводят не позже чем до 18 часов вечера, так как после него усиливается выведение мокроты, нужно время для ее откашливания.
Противопоказания
АЦЦ противопоказан при наличии:
Нужна осторожность при лечении пациентов с бронхиальной астмой, обструктивным бронхитом, аллергическими заболеваниями. Избегают назначать препарат больным с заболеваниями печени, почек, поражением надпочечников и высоким артериальным давлением.
Осложнения
Обычно АЦЦ хорошо переносится, нечастыми осложнениями бывают:
При появлении кожных реакций нужно прекратить применение и обратиться к врачу, так как при повышенной чувствительности к препарату может возникать тяжелое заболевание – токсический эпидермолиз (обширное отслоение эпителия кожи).
Чем дополняют АЦЦ против коронавируса
АЦЦ против коронавируса дополняют препаратами для улучшения отхождения мокроты: при влажном кашле его сочетают с Амброксолом для эффективного очищения дыхательных путей. Если инфекционное заболевание протекает со спазмом бронхов, то медикамент комбинируют с Сальбутамолом или Беродуалом.
При развитии коронавирусной пневмонии назначают противовирусные средства, иммуномодуляторы (Калетра, Плаквенил, Интерферон). Если выявлено присоединение бактериальной инфекции, то в план терапии включают Азитромицин и АЦЦ при коронавирусе.
Не рекомендуется вместе с препаратом использовать противокашлевые средства, активированный уголь. При одновременном назначении с антибиотиками нужен перерыв между ними и АЦЦ не менее 2 часов. Пациентам со склонностью к кровотечениям, низкой свертываемостью крови, язвенной болезнью нельзя использовать вместе Аспирин и АЦЦ.
Стоит ли принимать АЦЦ для профилактики коронавируса
АЦЦ не имеет прямого профилактического эффекта при коронавирусе COVID-19, тем не менее врачом может быть назначен курс применения препарата пациентам с хроническим воспалением бронхов, легких, бронхоэктатической болезнью, а также курильщикам. В таких случаях он может предупредить тяжелое течение коронавирусной инфекции. Но защитить от заражения АЦЦ не может, поэтому все рекомендации о мытье рук, сокращении контактов с окружающими остаются актуальными.
АЦЦ при коронавирусе используется для разжижения и выведения мокроты, облегчения влажного кашля. Его назначают при всех формах инфекционного заболевания в сочетании с откашливающими препаратами, противовирусными и антибиотиками.
Новые данные о роли ацетилсалициловой кислоты в лечении COVID-19
15 июня в ходе «Научного вторника» руководитель отдела фундаментальных и клинических проблем тромбоза при неинфекционных заболеваниях ФГБУ «НМИЦ ТПМ» Минздрава России, д.м.н. Игорь Семенович Явелов представил данные рандомизированных клинических исследований по использованию в лекарственной терапии COVID-19 ацетилсалициловой кислоты.
Доказано, что существенную роль в прогрессировании новой коронавирусной инфекции играют процессы тромбообразования. В настоящее время для лечения COVID-19 в стационаре широко применяют подкожное или внутривенное введение препаратов гепарина. Однако накапливаются факты, что полезными могут оказаться и препараты, снижающие функциональную активность тромбоцитов (антиагреганты), среди которых наиболее часто используется ацетилсалициловая кислота.
Так, по данным объединенного анализа 6 ретроспективных исследований, включавших в совокупности 13993 больных с COVID-19, применение низкой дозы ацетилсалициловой кислоты догоспитально или в стационаре указывало на двукратное снижение риска смерти при сравнении с не получавшими этот антиагрегант, вне зависимости от наличия других факторов, связанных с неблагоприятным исходом заболевания. Результаты анализа случаев начала применения ацетилсалициловой кислоты в стационаре оказался аналогичным. Вместе с тем, с одной стороны, столь выраженный положительный эффект выглядит неправдоподобно, с другой – известно, что свидетельства такого рода могут ввести в заблуждение, поскольку решение назначать или не назначать препарат у конкретного больного зависит от решения врача, мотивы которого далеко не всегда известны, и никогда нет уверенности в том, что группы сравнения были сходны (сопоставимы) по всем особенностям, способным оказать влияние на результат лечения. Определенный ответ на целесообразность того или иного подхода к лечению больных могут дать только рандомизированные клинические исследования.
Результаты первого из них оказались разочаровывающими: в многоцентровом открытом клиническом испытании RECOVERY назначение ацетилсалициловой кислоты в дозе 150 мг 1 раз в сутки до выписки у больных, госпитализированных с COVID-19, не оказало влияния на смертность за 28 дней наблюдения в сравнении со стандартным лечением заболевания без использования ацетилсалициловой кислоты. При этом не было пользы при начале лечения в первые 7 дней и в более поздние сроки от появления симптомов, при отсутствии потребности в поддержке дыхания/дыхании кислородом и различных формах поддержки дыхания, при использовании и не использовании кортикостероидов. Не было различий между группами и по частоте больных, нуждающихся в неинвазивной и инвазивной вентиляции легких, заместительной почечной терапии. При этом в основном изучение начиналось в первые дни после госпитализации, и исходно тяжесть заболевания не была критической (механическая искусственная вентиляция легких проводилась только у 5% больных).
В итоге пока нет оснований применять ацетилсалициловую кислоту у всех больных, госпитализированных с COVID-19. Ее изучение при этом заболевании (в том числе при лечении амбулаторно) продолжается в ряде рандомизированных клинических исследований. Соответственно, не исключено, что после появления новых фактов представления о роли ацетилсалициловой кислоты при COVID-19 будет уточнено или пересмотрено.
АЦЦ: обзор препарата
Кашель — реакция организма, направленная на освобождение дыхательных путей от инородных элементов. Таким образом кашель, проявляющийся в появлении заболеваний органов дыхания в последствии возникновения инфекционных и вирусных заболеваний возникает для освобождения бронхов и легких от вязкой слизи, которая образуется в них.
АЦЦ — муколитический лекарственный препарат, действие которого направлено на более быстрое разжижение слизи и ее легкое выведение. Именно поэтому препарат назначается как при так называемом сухом, так и влажном кашле. При этом следует помнить, что любое лекарственное средство принимается только после консультации со специалистом. Самостоятельно употребление АЦЦ может существенно снизить эффективность препарата и вызвать его побочные действия.
Состав АЦЦ
Главное действующее вещество лекарственного препарата — ацетилцистеин. В зависимости от формы выпуска АЦЦ могут присутствовать вспомогательные вещества.
Форма выпуска и дозировки
Выпускается АЦЦ в следующих формах:
Показания для АЦЦ
Перед приемом препарата обязательно необходимо проконсультироваться с лечащим врачом. Назначают АЦЦ при следующих заболеваниях:
Способы применения АЦЦ
Суточная доза препарата для взрослых и подростков от 14 лет не должна превышать 600 мг, детям от 6 до 14 лет рекомендуется не более 400 мг, детям до 5 лет — не более 300 мг АЦЦ в сутки. В отдельных случаях врач может увеличить суточную дозу лекарства.
В период простудных заболеваний, сопровождающихся кашлем с образованием мокроты прием АЦЦ осуществляется от 5 до 7 дней. При более тяжелых заболеваниях — муковисцидозоах и бронхитах продолжительность приема препарата может быть значительно дольше.
Раствор употребляют после еды. Рекомендуется также запивать лекарство, так как дополнительный прием жидкости способствует усилению действия препарата.
Противопоказания для АЦЦ
Ацц противопоказан в следующих случаях:
Особые рекомендации
При каком виде кашля применять АЦЦ
Кашель — один из главных симптомов, сопровождающих заболевания дыхательных путей инфекционного типа. В процессе воспаления дыхательных путей происходят изменения, провоцирующие образование вязкой слизи — мокроты.
АЦЦ при сухом кашле может применяться в самом начале заболевания, для ускорения перехода кашля из непродуктивного в продуктивный, или при малопродуктивном кашле для разжижения вязкой мокроты и ускорения ее отхождения.
Во время продуктивного кашля, благодаря АЦЦ отхождение мокроты происходит быстрее и легче, за счет чего очищаются бронхи и легкие. При этом мокрота становится более жидкой.
АЦЦ и заболевания почек
При заболеваниях почек в любой стадии АЦЦ принимают только после назначения врача и под его строгим контролем. Компоненты препарата могут конфликтовать с другими лекарственными препаратами, принимаемыми при почечной недостаточности и другими заболеваниями почек.
АЦЦ и алкоголь
Взаимодействие главного действующего компонента муколитического лекарственного препарата АЦЦ с этанолом не обнаружено. Вместе с тем это не значит, что препарат можно применять вместе с алкоголем.
Главное назначение любого лекарственного препарата — устранение инфекции, попавшей в организм и облегчение болезненного состояния организма, способствующее его дальнейшему выздоровлению. Алкоголь же наоборот — активно снижает защитные и восстановительные функции организма, усугубляя иммунодефицит организма. Соответственно эффективность лекарственного препарата также будет снижено алкоголем. К тому же употребление алкоголя может спровоцировать проявление побочных эффектов ацетилцистеина.
АЦЦ беременным и кормящим
АЦЦ детям
У детей при заболеваниях органов дыхания в результате вирусных или инфекционных заболеваний образование мокроты проходит иначе, чем у взрослых. Секрет, который выделяют бронхи, имеют более вязкую структуру. При этом грудная мускулатура ребенка значительно слабее, чем у взрослого. Именно поэтому откашливание мокроты у детей происходит намного тяжелее. К тому же мокрота, которая застаивается в детском организме может стать причиной более быстрого распространения инфекции так как является благоприятной средой для размножения вредоносных бактерий и вирусов.
Детский АЦЦ также назначается только врачом на основании предварительных исследований. Принимать препарат можно при первых проявлениях кашля. Это позволяет избежать застоя мокроты, так как препарат провоцирует ее разжижение облегчая тем самым ее откашливание.
Восстановление легких после коронавируса
Восстанавливаются ли легкие после COVID-19? Да. Но нужно не пропустить сроки реабилитации и серьёзно отнестись к рекомендациям врача.
Новая коронавирусная инфекция, вызванная SARS-CoV-2, недостаточно изучена, однако ясно, что она наносит вред всем органам и тканям человека. Вирус проникает в организм через слизистые оболочки носа, глаз, глотки. Первые симптомы появляются на 2-14 день. Обычно это повышение температуры выше 37.5 градусов Цельсия, насморк, потеря обоняния, сухой кашель, послабление стула, слабость и головная боль. На 6–10 сутки от момента появления первых симптомов могут начать беспокоить одышка, боль в груди, усиление кашля. Это тревожные симптомы, говорящие о поражении легких и требующие проведения дополнительного обследования: компьютерной томографии легких, измерения насыщения крови кислородом (сатурации).
Легкие после COVID-19
Попадая в организм человека через слизистые оболочки дыхательных путей SARS-CoV-2 вызывает мощнейшую воспалительную реакцию. Активируются иммунные клетки, вырабатывается колоссальное количество воспалительных веществ (воспалительных цитокинов). Интенсивность этой реакции скорее всего обусловлена генетически. Именно интенсивностью воспалительной реакции и определяется тяжесть поражения легочной ткани по данным исследований. В легочной ткани поражение при COVID-19 обусловлено как поражением самих альвеол (в которых происходит газообмен и кровь насыщается кислородом из воздуха) нашими собственными иммунными клетками так и поражением легочных сосудов, оплетающих альвеолы. Степень поражения легких можно определить при помощи КТ (компьютерной томографии).
Таблица 1. Поражение лёгких при COVID-19
Процент поражения легочной ткани
Поражена часть лёгкого. Небольшое затруднение дыхания.
N-ацетилцистеин в комплексном лечении COVID-ассоциированной пневмонии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Введение: имеющиеся на сегодня сведения о результатах терапии новой коронавирусной инфекции (COVID-19) всеми препаратами не позволяют сделать однозначный вывод об их эффективности или неэффективности, в связи с чем их применение допустимо по решению врачебной комиссии в установленном порядке, в случае если потенциальная польза для пациента превысит риск их применения. Выбор лекарственных средств для схем лечения COVID-19 основывается на данных об эффективности и безопасности, их механизме действия и потенциальных взаимодействиях. Фармакологическая активность N-ацетилцистеина (N-acetylcysteine, NAC) и потенциально возможное действие в подавлении прогрессирования COVID-19 делают его многообещающим терапевтическим средством при COVID-19.
Цель исследования: оценить эффективность NAC в комплексном лечении среднетяжелой COVID-ассоциированной пневмонии.
Результаты исследования: проведенное нами исследование показало, что включение NAC в комплексное лечение среднетяжелой COVID-ассоциированной пневмонии привело к статистически значимому повышению насыщения крови кислородом, индекса оксигенации, различию разности увеличения индекса оксигенации, более высокому темпу уменьшения объема поражения легких и межгрупповому различию разности уменьшения данного показателя. Также отмечены статистически значимо более интенсивный, чем в группе стандартного лечения, темп снижения уровня С-реактивного белка и сокращение длительности госпитализации в группе пациентов, получавших NAC.
Заключение: результаты проведенного исследования свидетельствуют об эффективности включения NAC в комплексное лечение среднетяжелой COVID-ассоциированной пневмонии.
Ключевые слова: COVID-ассоциированная пневмония, индекс оксигенации, объем поражения легких, длительность госпитализации, лечение, N-ацетилцистеин.
Для цитирования: Авдеев С.Н., Гайнитдинова В.В., Мержоева З.М. и др. N-ацетилцистеин в комплексном лечении COVID-ассоциированной пневмонии. РМЖ. 2021;3:13-18.
N-acetylcysteine in the complex treatment of COVID-19 pneumonia
1 Sechenov University, Moscow
2 Research Institute of Pulmonology of the Russian Federal Medical Biological Agency, Moscow
Background: the available data on the treatment results of a new coronavirus infection (COVID-19) using all medicinal products do not allow for making a firm conclusion about their efficacy or inefficacy. Therefore, their use is permissible by decision of the medical commission in accordance in the prescribed manner, if the potential benefit to the patient exceeds the risk of their use. Drug choice for COVID-19 treatment regimens is based on data on efficacy and safety, their mechanism of action, and potential interactions. Pharmacological activity of N-acetylcysteine (NAC) and its potential effect in inhibition the progression of COVID-19 make it a promising therapeutic agent in COVID-19.
Aim: to evaluate the efficacy of NAC in the comprehensive treatment of a moderate COVID-19 pneumonia.
Results: this study showed that the inclusion of NAC in the comprehensive treatment of moderate COVID-19 pneumonia led to a statistically significant increase in the oxygen saturation, oxygenation index, difference in delta increase of the oxygenation index, higher rate of decline in the volume of lung damage and inter-group difference in delta decline. There was also a statistically significantly more intense rate of a decrease in C-reactive protein levels than in the standard treatment group and a reduction of hospitalization duration in the group receiving NAC.
Conclusion: study results indicated the efficacy of NAC inclusion in the comprehensive treatment of moderate COVID-19 pneumonia.
Keywords: COVID-19 pneumonia, oxygenation index, lung damage volume, hospitalization duration, treatment, N-acetylcysteine.
For citation: Avdeev S.N., Gainitdinova V.V., Merzhoeva Z.M. et al. N-acetylcysteine in the complex treatment of COVID-19 pneumonia. RMJ. 2021;3:13–18.
Введение
Ведущими клиническими проявлениями новой коронавирусной инфекции COVID-19 являются вирусное повреждение легких (вирусная пневмония) и острый респираторный дистресс-синдром (ОРДС) с развитием острой дыхательной недостаточности (ОДН) [1, 2].
Доказано, что связывание вируса SARS-CoV-2 с толл-подобным рецептором (Toll-like receptor, TLR) индуцирует высвобождение про-ИЛ-1β, который расщепляется на активный зрелый ИЛ-1β, опосредующий воспаление легких с последующим развитием фиброза [7, 8].
Повышение содержания ИЛ-6, основного цитокина, вызывающего воспаление при COVID-19, способствует развитию митохондриального окислительного стресса и дисбаланса в системе оксиданты/антиоксиданты. Окислительно-восстановительный дисбаланс в клетках альвеолярного эпителия, их апоптоз, усиление воспаления и, как следствие, нарушение газообмена вызывают и местное повышение уровня ангиотензина 2 после инактивации ангиотензинпревращающего фермента 2 вирусом SARS-CoV-2 [9, 10].
Оксиданты активируют транскрипционные факторы и передачу клеточного сигнала, инициируют экспрессию провоспалительных генов, приводя к выраженному воспалению в легочной ткани и системному воспалению [11, 12]. Эндогенная недостаточность основного внутриклеточного антиоксиданта — глутатиона и повышение содержания глутатионредуктазы могут приводить к серьезным проявлениям COVID-19 и летальному исходу [9, 10]. Согласно накопленным литературным данным ослабление оксидативного стресса может уменьшать повреждение легких [10].
Потребность в безопасном и эффективном лечении становится все более актуальной из-за высоких показателей смертности от COVID-19, наблюдаемых во всем мире. Выбор лекарственных средств (ЛС) для схем лечения COVID-19 основывается на данных об их эффективности и безопасности, механизме действия и потенциальных взаимодействиях. Также учитывается способность ЛС усиливать физиологический ответ человеческого организма на воспаление, их потенциал способствовать гомеостазу клинических маркеров воспаления, а также возможность действовать на ранних стадиях заболевания. Фармакологическая активность N-ацетилцистеина (N-acetylcysteine, NAC) и потенциально возможное действие в подавлении прогрессирования COVID-19 делают его многообещающим терапевтическим средством при COVID-19 [13].
NAC подавляет окислительный стресс, выступая в качестве проницаемого для клеток аминокислотного предшественника глутатиона и разрывая дисульфидные связи внутри ангиотензинпревращающего фермента 2 — клеточного рецептора для SARS-CoV-2 [12]. Кроме того, NAC подавляет формирование провоспалительных цитокинов, таких как ИЛ-8 и ФНО-α [13]. В многочисленных исследованиях было показано, что NAC с успехом может использоваться при различных заболеваниях легких [14]. Протективные эффекты NAC при ОРДС продемонстрированы во многих экспериментальных и клинических исследованиях [1].
Благодаря механизму действия, направленному на увеличение глутатиона, улучшение ответа Т-лимфоцитов и модулирование воспаления, NAC может выступать в качестве потенциального ЛС при лечении COVID-19 [6, 15]. Принимая во внимание наличие системного воспаления, следует отметить, что NAC может также защищать от вызванного окислительным стрессом эндотелиального повреждения, которое активирует высокотромботический подтип синдрома диссеминированного внутрисосудистого свертывания, наблюдаемого при COVID-19 [16].
В связи с этим целью настоящего исследования стала оценка эффективности NAC в комплексном лечении среднетяжелой COVID-ассоциированной пневмонии.
Материал и методы
В исследование включены взрослые пациенты (n=46) со среднетяжелой COVID-ассоциированной пневмонией КТ 2-й степени. Пациенты находились на лечении в COVID-госпитале, функционирующем на базе Университетской клинической больницы № 4 ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России.
Наличие COVID-19 подтверждалось лабораторными исследованиями (мазок на РНК вируса SARS-CoV-2 из верхних дыхательных путей методом ПЦР) и/или клинико-рентгенологически (наличие характерной клинической картины и характерных признаков полисегментарной вирусной пневмонии COVID-19). При постановке диагноза и назначении лечения COVID-ассоциированной пневмонии руководствовались временными методическими рекомендациями «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» Минздрава России, версия 9, 26.10.2020 [1].
Критериями включения в исследования были: температура тела >38 °C, частота дыхательных движений (ЧДД) >22/мин, одышка при физических нагрузках, изменения при КТ, типичные для вирусного поражения (объем поражения средний (25–50%), КТ 2-й степени), насыщение крови кислородом (SpO2) 10 мг/л.
Критерии исключения из исследования: несоответствие критериям включения, неспособность соблюдения пациентом условий протокола; отказ пациента от исследования.
У всех больных оценивались демографические показатели, индекс массы тела (ИМТ), альтернативный индекс оксигенации (SpO2/FiO2 — отношение насыщения крови кислородом к фракции вдыхаемого кислорода), симптомы заболевания, данные объективного, лабораторного (общий анализ крови, СРБ, коагулограмма) и инструментального (КТ органов грудной клетки) исследований, сопутствующие заболевания. Для выявления дыхательной недостаточности (ДН) и оценки выраженности гипоксемии использовалась пульсоксиметрия с измерением насыщения крови кислородом.
ДН определялась в соответствии с классификацией по степени тяжести, основанной на показателях пульсоксиметрии (SpO2). Для оценки питательного статуса пациентов использовался ИМТ, который рассчитывался по общепринятой формуле: ИМТ = масса тела (кг) / рост (м 2 ). Индекс оксигенации SpO2/FiO2 рассчитывался по формуле:
SpO2 / 21 + 3 × скорость потока кислорода [17].
Пульсоксиметрия проводилась с помощью пульсоксиметра серии MD300C (Armed, Россия). КТ легких проводилась на спиральном компьютерном томографе Aquillion TSX-101A (Toshiba Medical Medical Systems, Япония), толщина среза — 1 мм, при поступлении и через 10 дней от начала лечения.
Количественное определение СРБ в сыворотке крови определяли латексным иммунотурбидиметрическим методом (анализатор Beckman Coulter, США, серия AU, с использованием реагентов CRP Latex, Россия) в 1-й, 3-й и 10-й день наблюдения.
Фибриноген определялся в плазме крови (анализатор АСК 2–01 «Астра») с использованием наборов НПО «Ренам», Россия. Д-димеры определяли методом микролатексной агглютинации с фотометрической регистрацией реакции (иммунотурбидиметрия), с использованием наборов «РеДимер-латекс», тест НПО «Ренам», Россия.
Случайным образом были сформированы 2 группы исследования. 1-я группа (контроль, n=22) получала стандартное лечение [1]: гидроксихлорохин 200 мг, 800 мг/сут в 1-й день, 400 мг/сут 2–7-й дни; азитромицин 500 мг/сут 5 дней, эноксапарин натрия 0,4 мг/сут подкожно, дексаметазон 8–12 мг/сут, при СРБ ≥60 мг/л — тоцилизумаб 400 мг/сут. Пациенты 2-й группы (n=24) дополнительно получали NAC (Флуимуцил, Швейцария) 1200–1500 мг/сут внутривенно капельно № 8–10. NAC назначался одновременно с началом стандартной терапии.
Статистическая обработка данных проводилась с использованием пакета прикладных программ IBM SPSS Statistics, version 22 (лицензия 20160413–1). Описательная статистика исходных количественных признаков представлена медианой и интерквартильным размахом. Помимо исходных признаков анализировалась разность изменения каждого показателя (разница до и после лечения) и интенсивность темпа изменения показателя (разность изменения относительно исходного уровня, выраженная в процентах). Описательная статистика разности и интенсивности изменений представлена средним и стандартным отклонением. Сравнение двух независимых выборок (группа NAC и контрольная группа) по количественному показателю проводилось с применением критерия Манна — Уитни (U), зависимых (до — после лечения) — критерием Вилкоксона для связанных выборок (W). Сравнение трех независимых выборок по количественному показателю (в разные моменты исследования) проводилось критерием Фридмана, апостериорные сравнения проводились критерием Немени. Оценку различий срока госпитализации пациентов (койко-дней в стационаре) 2 групп проводили с использованием техники Каплана — Мейера и критерия Тарона — Вэра.
Результаты исследования
Согласно результатам рандомизированного контролируемого исследования NAC связывается с глутамином и глицином, образуя мощный антиоксидант, известный как глутатион, который, как было показано, противодействует воспалительной реакции при внебольничной пневмонии [15, 16]. Добавление NAC в лечение пациентов с внебольничной пневмонией снизило концентрацию малонового диальдегида, супероксиддисмутазы, общую антиоксидантную активность, уровень ФНО-α. Авторами сделан вывод, что лечение NAC может помочь уменьшить окислительное и воспалительное повреждение у пациентов с пневмонией [15]. В другом исследовании было обнаружено, что NAC снижает уровень ИЛ-6-зависимого СРБ при пневмонии, вызванной гриппом AH1N1 [18].
Применение NAC способствует уменьшению активности воспаления в легочной ткани. На фоне лечения NAC происходит увеличение содержания нейтрофилов в периферической крови на фоне уменьшения их представительства в ткани респираторного тракта, снижения активности фактора транскрипции NF-κB в клетках респираторного тракта и снижения концентрации эозинофильных катионных белков в мокроте [14].
Известно, что NAC предотвращает действие трансформирующего фактора роста β1 (Transforming growth factor β1, TGF-β1), которое способствует эпителиально-мезенхимальной трансдифференцировке и индуцирует фиброзирование. Показано, что NAC уменьшает активность TGF-β1-индуцированной продукции фибронектина, сосудистого эндотелиального фактора роста и коллагена. Также NAC подавляет фосфорилирование фактора Smad 2/3, препятствует димеризации мономеров TGF-β1, ингибирует функционирование TGF-β1-индуцированного гена-репортера [19].
В исследовании Н. Ibrahim (2020) NAC вводили 9 пациентам с тяжелой формой COVID-19 и дыхательной недостаточностью. На фоне лечения NAC отмечены клиническое улучшение, заметное снижение уровня СРБ у всех пациентов и уровня ферритина у 9 из 10 пациентов. Авторы предположили, что механизм действия NAC может включать блокаду вирусной инфекции и развивающегося «цитокинового шторма», что требует последующих подтверждающих исследований в рамках контролируемых клинических испытаний [12].
В то же время в двойном слепом рандомизированном плацебо-контролируемом одноцентровом исследовании, проведенном в Бразилии, изучено влияние высоких доз NAC на потребность в искусственной вентиляции легких и ее длительность, поступление в отделение интенсивной терапии, время, проведенное в этом отделении, и смертность. Результаты исследования показали, что прием NAC в высоких дозах не повлиял на развитие тяжелого течения COVID-19 и на изучаемые показатели [20].
С учетом вышеизложенного необходимы дальнейшие исследования для оценки эффективности NAC при COVID-19.
Заключение
Включение NAC в комплексное лечение среднетяжелой COVID-ассоциированной пневмонии привело к статистически значимому повышению насыщения крови кислородом, индекса оксигенации, различию разности увеличения индекса оксигенации, более высокому темпу уменьшения объема поражения легких и межгрупповому различию разности уменьшения данного показателя. Также отмечены статистически значимо более интенсивный, чем в группе контроля, темп снижения уровня СРБ и сокращение длительности госпитализации в группе NAC. Таким образом, результаты проведенного исследования свидетельствуют о целесообразности включения NAC в комплексное лечение среднетяжелой COVID- ассоциированной пневмонии.
Редакция благодарит компанию ООО «Замбон Фарма» за оказанную помощь в технической редактуре настоящей публикации.
Только для зарегистрированных пользователей