раствором перманганата калия нельзя распознать
Перманганат калия
В каждой домашней аптечке обязательно есть марганцовка —бытовое дезинфицирующее средство.
Научное название этого соединения — перманганат калия КМnО4. Оно представляет собой калиевую соль сильной марганцевой кислоты НМnO4, в которой марганец находится в высшей степени окисления (+7). Поэтому неудивительно, что КМnO4 является сильным окислителем. На свету он окисляет даже воду с выделением молекулярного кислорода.
Растворите в воде несколько кристалликов КМnO4 и подождите некоторое время. Вы заметите, что малиновая окраска раствора постепенно станет более бледной, а затем и совсем исчезнет. На стенках сосуда образуется коричневый налет оксида марганца (IV):
4 КМп04 + 2 Н20 = 4 MnO2 + 4 КОН + 3O2.
Многие считают, что перманганат калия хорошо растворим в воде. На самом деле растворимость этой соли при комнатной температуре (20°С) составляет всего 6,4 г на 100 г воды. Однако раствор имеет настолько интенсивную окраску, что кажется концентрированным.
В промышленности КМпO4 получают электролизом концентрированного раствора гидроксида калия с марганцевым анодом (анод — это электрод, на котором идет процесс окисления).
В процессе электролиза материал анода постепенно растворяется с образованием знакомого всем фиолетового раствора, содержащего перманганат-ионы.
На катоде происходит выделение молекулярного водорода. Схему электролиза можно представить в виде уравнений реакций:
Мn + 8 ОН — 7 е = МпO4ˉ+ 4 Н20 (анод);
4 Н2O + 2 е = Н2 + 2 ОНˉ (катод).
Суммарное уравнение реакции можно записать следующим образом:
2 Мn + 2 КОН+ 6 Н20 = 2 КМпO4 + 7 Н2.
Умеренно растворимый в воде перманганат калия выделяется в виде осадка.
Было бы заманчиво вместо привычной марганцовки производить перманганат натрия, ведь гидроксид натрия доступнее, чем гидроксид калия. Однако в этих условиях выделить NaMn04 практически невозможно: в отличие перманганата калия, он прекрасно растворим в воде — при 20 °C его растворимость составляет 144 г на 100 г воды.
Перманганат калия — очень сильный окислитель. Он может реагировать со многими органическими и неорганическими соединениями. Чем больше электронов способен принять окислитель в ходе реакции, тем большее количество молей другого вещества он окислит.
Число электронов, переходящих к окислителю, зависит от условий проведения реакции, например от кислотности среды. Так, в нейтральной или слабощелочной среде перманганат-ион восстанавливается до диоксида марганца:
МnO4ˉ+ 2 Н2O + 3 еˉ = MnO2 + 4ОНˉ
Но особенно ярко окисляющая способность перманганата проявляется в кислой среде:
МnO4ˉ+ 8 Н+ + 5 еˉ = Мn2+ + 4 Н2O
Подкисленный крепкий раствор перманганата буквально сжигает многие органические соединения, превращая их в углекислый газ и воду. Этим иногда пользуются химики для мытья лабораторной посуды, загрязненной плохо смываемыми остатками органических веществ.
В домашних условиях тоже можно использовать марганцовку для пользы дела, например, чтобы почистить фаянсовую раковину в ванной.
Для того чтобы получить самодельное «моющее средство», надо смешать марганцовку с кислотой. Конечно, не со всякой. Некоторые кислоты могут сами окисляться. В частности, если взять соляную кислоту, то из нее выделится ядовитый хлор:
2 КМпO4 + 16 HCI = 5 CI2 + 2 MnCI2 + 2 KCI + 8 Н20.
Так его часто и получают в лабораторных условиях. Поэтому для наших цепей лучше использовать разбавленную (примерно 5-процентную серную кислоту). В крайнем случае, ее можно заменить разбавленной уксусной кислотой — столовым уксусом.
Возьмем примерно 50 мл (четверть стакана) раствора кислоты, добавим 1−2 г перманганата калия (на кончике ножа) и тщательно перемешаем деревянной палочкой. Затем промоем ее под струей воды и привяжем к концу кусок поролоновой губки.
Вот этой «кисточкой» быстро, но аккуратно размажем окислительную смесь по загрязненному участку раковины. Вскоре жидкость начнет менять цвет на темно-вишневый, а затем — на коричневый. Значит, реакция окисления пошла полным ходом.
Работать надо очень осторожно. Чтобы смесь не попала на руки и одежду, хорошо бы надеть клеенчатый фартук.
И не следует медлить, так как окислительная смесь очень едкая и со временем съедает даже поролон.
После использования поролоновую «кисть» нужно погрузить в заранее приготовленную банку с водой, промыть и выбросить.
Во время подобной очистки раковины может появиться неприятный запах, издаваемый продуктами неполного окисления органических загрязнений на фаянсе и самой уксусной кислоты. Поэтому помещение должно проветриваться.
Минут через 15−20 побуревшую смесь следует смыть струей воды. И хотя раковина предстанет в ужасном виде — вся в бурых пятнах, волноваться не стоит: продукт восстановления перманганата калия (диоксид марганца Мп02) легко удалить, восстановив его до хорошо растворимой соли марганца (II).
Сделать это лучше всего с помощью такого восстановителя как пероксид водорода Н2O2. Лучше взять, аптечный 3-процентный раствор. Вместо аптечного пероксида можно использовать таблетки гидроперита — соединения пероксида водорода с мочевиной состава CO (NH2)2∙H2O2.
Это не химическое соединение, поскольку между молекулами мочевины и пероксида водорода нет химических связей. Молекулы Н2O2 как бы включаются в длинные узкие каналы в кристаллах мочевины и не могут оттуда выйти, пока вещество не растворят в воде. Поэтому такие соединения называют соединениями включения.
Одна таблетка гидроперита соответствует 15 мл (столовая ложка) 3-процентного раствора пероксида водорода. Для получения 1-процентного раствора Н2O2 берут две таблетки гидроперита и 100 мл воды.
Используя Н2O2 в качестве восстановителя Мп02, нужно знать одну тонкость. Мп02 — хороший катализатор разложения пероксида водорода на воду и кислород:
И если просто обработать раковину раствором Н202, то он мгновенно «вскипит», выделяя кислород, а бурый налет так и останется (ведь катализатор не должен расходоваться в ходе реакции). Кстати аналогичную реакцию иногда рекомендуют для лечения больных десен: их сначала обрабатывают слабым раствором марганцовки, а потом пероксидом водорода. Выделяющийся при реакции молекулярный кислород и является главным лечебным средством. Поэтому процедуру так и называют — «кислородные ванночки»
Чтобы избежать каталитического разложения Н2O2, нужна кислая среда. Здесь тоже подойдет уксус. Сильно разбавим аптечную перекись, добавим немного уксуса и этой смесью промоем раковину. Произойдет настоящее чудо: грязно-бурая поверхность засверкает белизной и станет как новая. А чудо случится в полном соответствии с реакцией:
МnO2 + Н2O2 + 2 Н+ = O2 + Мn2+ + 2 Н2O.
Остается только смыть хорошо растворимую соль марганца струей воды.
Для снятия налета МпO2 можно использовать в качестве восстановителей также водные растворы органических кислот: щавелевой, лимонной, винной и др. Причем специально подкислять их не понадобится — кислоты сами создают в водном растворе достаточно кислую среду.
Тест с ответами: “Арены”
1. Толуол, в отличие от бензола:
а) окисляется раствором перманганата калия +
б) подвергается гидрированию
в) окисляется кислородом воздуха
2. До каких продуктов горит бензол:
а) угарный газ и вода
б) углекислый газ и вода +
в) сажа и вода
3. Бромную воду не обесцвечивает каждое из двух веществ:
а) ацетилен и толуол
б) этан и этилен
в) бензол и бутан +
4. Реакция с каким агентом может являться примером реакции присоединения в бензольном кольце:
а) гидрирование +
б) нитрование
в) хлорирование с катализатором
5. К реакциям замещения относится взаимодействие:
а) бензола и кислорода
б) бензола и водорода
в) бензола и азотной кислоты +
6. Реакция с каким агентом может являться примером реакции замещения в бензоле:
а) хлорирование на свету
б) хлорирование с катализатором +
в) гидрирование
7. Для бензола характерны свойства:
а) обесцвечивает бромную воду
б) растворим в воде
в) сильно токсичен +
8. Для каких целей бензол добавляется к бензину:
а) для повышения качества +
б) для разжижения
в) для меньшей летучести
9. Для бензола характерны свойства:
а) растворим в воде
б) горит бесцветным пламенем
в) бесцветная жидкость с резким запахом +
10. Как называется радикал С6Н5—:
а) аллил
б) фенил +
в) бензил
12. Какой катализатор используется при нитровании бензола:
а) серная кислота очень разбавленная
б) серная кислота концентрированная +
в) серная кислота разбавленная
13. При пропускании толуола через раствор перманганата калия наблюдается:
а) обесцвечивание раствора +
б) выпадение белого осадка
в) выделение газа
14. Какой катализатор нельзя использовать при хлорировании бензола:
а) AlCl3
б) FeCl3
в) Pt +
15. Вещество, формула которого С6Н5-СН2-СН3 относится к гомологическому ряду класса:
а) арены +
б) алкины
в) алканы
16. Какой физический смысл несёт вписанная окружность в структурной формуле бензола:
а) пространственно ориентированные связи
б) делокализацию электронной плотности +
в) круговые связи
17. Бензол из ацетилена в одну стадию можно получить реакцией:
а) дегидрирования
б) гидрирования
в) тримеризации +
18. Какой ученый предложил структурную формулу бензола, которая используется до сих пор:
а) Клаус
б) Кекуле +
в) Полинг
19. Как гексан, так и бензол взаимодействуют с:
а) водородом
б) раствором перманганата калия
в) хлором +
20. Какое вещество тримеризуется с образованием бензола:
а) этилен
б) ацетилен +
в) меркаптан
21. Как гексан, так и бензол взаимодействуют с:
а) кислородом +
б) водородом
в) раствором перманганата калия
22. С толуолом взаимодействует каждое из двух веществ:
а) НСl и KMnO4
б) HNO3 и Br2 +
в) KOH и H2SO4
23. Бензол может взаимодействовать с каждым из двух реагентов:
а) бромной водой и кислородом
б) водородом и бромной водой
в) бромом и азотной кислотой +
24. При действии на толуол раствора перманганата калия образуется:
а) С6Н5NO2
б) С6Н5СООН +
в) СН3Сl
25. При каталитическом гидрировании бензола образуется:
а) метилциклогексан
б) толуол
в) циклогексан +
26. Толуол образуется при взаимодействии бензола с:
а) С2Н5Cl
б) СН3Сl +
в) СН4
27. Природным источником ароматических углеводородов является:
а) каменный уголь +
б) подземные воды
в) попутный нефтяной газ
28. Толуол и бензол:
а) структурные изомеры
б) геометрические изомеры
в) гомологи +
29. Бромбензол образуется при взаимодействии бензола с:
а) бромом в присутствии катализатора +
б) бромом на свету
в) бромоводородом
30. В схеме превращений С2Н2→Х→С6Н5Cl веществом «Х» является:
а) С2Н6
б) С6Н6 +
в) СН4
Бывают случаи, когда спички промокли или закончились, а развести огонь просто необходимо.
Иногда от этого зависит судьба целой планеты. Помните фильм «Пятый элемент» с Брюсом Уиллисом?! 😉
Что делать? Уже темнеет, и оставаться вечером без согревающего тепла в лесу никто не хочет. Тут на помощь Вам придут знания химии.
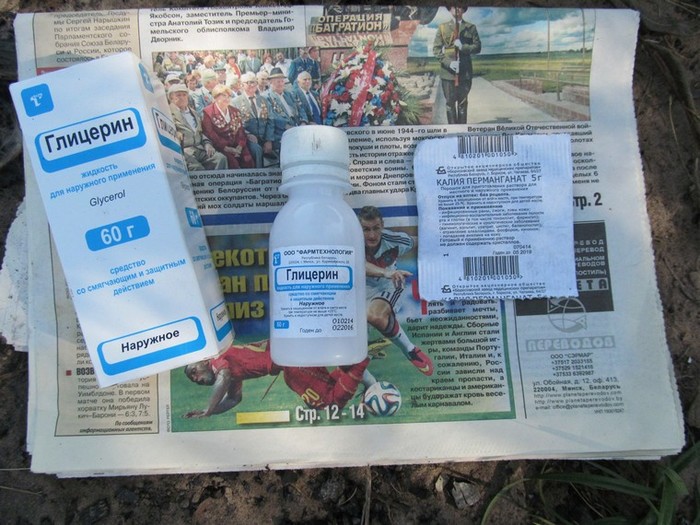
Для того чтобы разжечь костер химическим способом нам понадобится марганцовка, глицерин и газета. Все эти компоненты легкодоступны и у туристов могут находятся в походной аптечке 🙂
Порядок действий:
1) Высыпать марганцовку из пакетика горкой на газету.
2) Палочкой сформировать углубление-кратер в вершине горки.
3) Капнуть две капли глицерина в углубление.
4) Подождать когда начнется реакция (выделение дыма) и капнуть еще каплю.
5) Произойдет яркая вспышка света и загорится огонь, который нам был и нужен.
6) Подложить заранее подготовленные щепки и веточки в огонь для разведения полноценного костра.
Почему так происходит, что это за реакция, и как она впервые была получена.
Описание:
В горку из кристаллов перманганата калия капнули немного глицерина. Через некоторое время над смесью появляется дымок, а затем происходит загорание глицерина. Под действием сильных окислителей (марганцовки) глицерин сгорает с образованием углекислого газа и воды.
Для ускорения реакции мы добавили капельку воды. При добавлении алюминиевой стружки, она сгорает вместе со смесью с большим выделением света.
Подробнее:
В 1779 г. шведский аптекарь-химик Карл Шееле впервые получил глицерин и назвал полученную жидкость «сладкое масло».
Изучая свойства глицерина, он однажды смешал его с кристаллическим перманганатом калия. Неожиданно произошла яркая вспышка смеси.
Теперь этот эффектный опыт осуществляют следующим образом. В фарфоровую чашку или на керамическую плитку насыпают в виде горки тщательно растертый перманганат калия КМnО4 (мы в своем опыте придерживались исторического варианта и не растирали кристаллы).
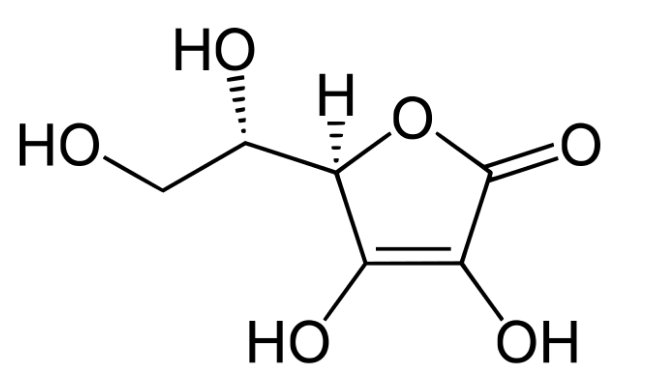
В вершине горки делают небольшое углубление и вносят туда несколько капель безводного глицерина С3Н5(ОН)3.
Примерно через одну минуту смесь воспламеняется, при этом происходит вспышка фиолетового цвета, горение сопровождается разбросом раскаленных частиц продуктов реакции.
Реакцию можно выразить уравнением:
14КМnО4 + 3С3Н5(ОН)3 = 7K2CO3 + 14MnO2 + 12H2O + 2CO2
Взаимодействие сопровождается выделением большого количества теплоты и газов (углекислый газ СО2 и пары воды Н2О), которые увлекают за собой горячие твердые частицы диоксида марганца МnО2 и карбоната калия К2CO3.
Данная реакция получила название «вулкан Шееле».
А марганцовку разве сейчас продают?
Никогда не выхожу из дома без мешка марганцовки и канистры глицерина. Вдруг чо.
А вообще проще купить браслет из паракорда, с огнивом. Легкий, место не занимает, всегда при тебе.
Мне в школе на уроках химии рассказывали про такую реакцию. Обычная советская школа.
Всегда смешно смотреть Высоцкую «едим дома». у каждого россиянина в холодильнике : оливковое масло, сухое итальянское вино, каперсы, сыр мацарела, мраморная говядина и ссука коричневый сахар
И ведь так случайно было много чего изобретено)) правда не все живы видимо остались.
сразу вспоминаю сцену из неуловимых
Я бы опасался туристов с глицерином в аптечке. Могут ведь и нашампурить xD
Как сделать бесцветный огонь
Колдун. (для тех, кто не учился в школе. )
Аскорбиновая кислота, и с чем её едят
Все мы знаем нужность и важность витаминов. Vita = жизнь, если латинско-русский словарь не врёт (а он не врёт). И, наверное, самым известным является витамин C, он же Аскорбиновая кислота.
Слишком сложно? Тогда ну его, давайте просто поговорим об аскорбинке, как о витамине. Зачем она нужна? О, функций у этого вещества не просто много, а очень много. Загибайте пальцы.
— Участвует в биосинтезе (ещё не надоела повторяющаяся формулировка? А что делать. таких тут будет много) кортикостероидов (гормоны гидрокортизон, кортизон, альдостерон).
— Участвует в биосинтезе желчных кислот из холестерина.
— Улучшает всасывание железа, поступающего с пищей.
— Участвует в процессах детоксикации в гепатоцитах.
— Нейтрализует супероксидный радикал (один из тех самых «свободных радикалов», которыми одно время активно пугали из телерекламы, и который таки да, не подарок).
— Стимулирует биосинтез интерферонов (вещества, отвечающие за иммунный ответ, сорри за тавтологию).
— Наконец, есть данные о работе аскорбиновой кислоты как нейропротекторе (защитнике нервных клеток).
Не вещество, а какой-то Фигаро, да? Фигаро тут, Фигаро там. Нарасхват!
В каких же овощах-фруктах его больше всего? Самое распространённое мнение: в лимонах. Мнение это ошибочное. Лимон, конечно, штуковина кислая, но кислот в мире органики существует огромное количество. Кислота лимона обусловлена не аскорбинкой. А одним из лидеров по содержанию витамина С является, внезапно, чёрная смородина. Эта ягода уделывает по аскорбинке лимоны в лёгкую: 180 мг/100 г смородины против 50 мг/100 г лимона.
Кроме смородины, много (больше «лимонного») витамина C в петрушке, болгарском перце, киви, укропе, хурме, клубнике и даже в апельсине. Мы, разумеется, перечисляем те продукты, которые есть везде. Всякая экзотика, типа гуавы, тоже порой богата аскорбинкой, но наверное у вас возле дома гуавового магазинчика нет? А в гипермаркетах, к слову, не игнорируйте экзотические фрукты: там много вкусного и полезного и помимо витамина C (конечно, аллергикам стоит с этим осторожничать, но они и сами в курсе).
Что до таблеток с «витаминками», то здесь просто надо не переусердствовать. Распространённые «шипучки», где витамина С содержится аж 1 грамм, можно и нужно применять (по назначению врача, конечно), но не постоянно. Люди обычно пьют аскорбинку в осенне-зимний период, когда свежих овощей меньше, а холодов и прочего погодного дискомфорта больше. И в интернете то и дело появляются «откровения» на тему «совершенно не доказано, что аскорбинка защищает от простуды».
Ну так никто и не обещает сильного, прямо-таки чудодейственного влияния аскорбиновой кислоты на проблемы со здоровьем. Болезни, если это не цинга, как правило, лечат соответствующими лекарственными препаратами, а не таблетками аскорбинки. Но мягкое и ненавязчивое влияние, конечно, будет. Аскорбинка, в составе комплексных мер оздоровления, нужна. Биохимически это вполне очевидно.
Так что, итоговый вывод такой: аскорбинку пить можно, и, временами, нужно.
PS. Аскорбиновая кислота не является специфическим средством профилактики Covid19. Принимать её можно в составе комплекса защитных мер (маски, дезинфекция рук и поверхностей и т.п. и т.д.)
Источник: наш витаминизированный канал «Биохимикум» на Яндекс.Дзен. Текст статьи мой, апельсины на фото, наверное, марокканские. Там их много. 🙂 А вот с бананами в Эквадоре, говорят, неурожай.
Ответ на пост «Школьники-бомбисты»
Я тоже много чего в юности поджигал и взрывал.
1. Была неподалёку старая мертвая ель, у которой сгнила сердцевина ствола, а верхушка была отломлена. Я ее как-то снизу поджег, что она доверху изнутри прогорела с дикой тягой. Последствий для меня не было.
Контрольная работа по теме: «Углеводороды», 10 класс
Контрольная работа по теме: «Углеводороды», 10 класс
1-а вариант.
Задание 1.
Тестовые вопросы с одним вариантом ответа:
1. Бутадиен-1,3 и бутин-1 являются изомерами
1)углеродного скелета 2)межклассовыми 3)геометрическими 4)положения кратных связей
2. Для алканов характерны реакции:
1)полимеризации 2)присоединения 3)замещения 4)обмена
3. Как пропан, так и пропен взаимодействует:
1)с водородом 2)с хлороводородом 3)с кислородом 4)с раствором перманганата калия
4. Хлорэтан нельзя получить взаимодействием:
1)хлороводорода и этанола 2)хлора и этилена 3)хлороводорода и этилена 4)хлора и этана
5. Взаимодействие этилена и воды относят к реакциям:
1)гидролиза 2)гидратации 3)гидрирования 4)дегидратации
6. Верны ли следующие суждения о природных источниках углеводородов:
А)Наиболее ценная фракция перегонки нефти – керосин
Б)Нефть – это смесь только предельных углеводородов
1)верно только А 2) верно только Б 3) оба суждения верны 4) оба суждения неверны
Тестовые вопросы с несколькими правильными вариантами ответа
7. Этилен можно получить в результате реакции:
1)дегидрирования этана 2)дегидратации этанола
3)дегидрохлорирования хлорэтана 4) гидролиза карбида кальция
5)окисления ацетальдегида 6)пиролиза метана
8. Бромную воду обесцвечивает каждое из веществ:
1)бензол и толуол 2)этан и этилен 3)бутадиен-1,3 и пропин-2 4)ацетилен и метан
Задание на установление соответствия
9. Установите соответствие между названием соединения и общей формулой отвечающего ему гомологического ряда