Трансплантат против хозяина что это
Трансплантат против хозяина что это
Хроническую реакцию трансплантат против хозяина (РТПХ) наблюдали у 30—60 % больных после алло-ТГСК. Она может возникнуть самостоятельно или быть продолжением острой реакции трансплантат против хозяина.
Клиническими проявлениями хронической реакции трансплантат против хозяина являются склеротические изменения кожи, эритродермия, депигментация (гиперпигментация), алопеция, поражение желудочно-кишечного тракта (с развитием синдрома мальабсорбции), легких, печени, суставов, мышц, глаз, атрофия лимфоидных органов. Эти проявления сходны с симптомами, наблюдаемыми при различных аутоиммунных заболеваниях, например склеродермии, но такое подобие не является полным вследствие редкого развития осложнений со стороны пищевода и почек. Различают ограниченную и распространенную формы хронической реакции трансплантат против хозяина в зависимости от степени вовлечения в процесс кожи, печени, кишечника.
Основными факторами, предрасполагающими к развитию хронической реакции трансплантат против хозяина, являются вид трансплантации (родственная, неродственная), источник ГСК (КМ, ПСКК), возраст реципиента старше 20 лет, применение трансплантата без Т-клеточного «истощения», введение реципиенту мужчине аллоиммунизированных клеток донора женщины, наличие предшествующих проявлений острой реакции трансплантат против хозяина II—IV стадии, вариант гемобла-стоза (чаще при ХМЛ), режим кондиционирования с применением ТОТ, факт переливания необлученных компонентов крови и наличие герпетической инфекции у донора или реципиента.
Вероятность развития хронической реакции трансплантат против хозяина после родственной совместимой алло-ТГСК составляет 40%, родственной несовместимой алло-ТГСК — 50 %, неродственной алло-ТГСК — до 70 %.
Возраст — важный прогностический фактор развития хронической реакции трансплантат против хозяина. У больных до 10 лет вероятность возникновения хронической реакции трансплантат против хозяина после родственной алло-ТГСК равна 13 %, в то время как у больных старше 20 лет — 46 %.
Хроническая реакция трансплантат против хозяина достоверно увеличивает летальность, связанную с трансплантацией, что обусловлено в большинстве случаев возникновением тяжелых инфекционных осложнений на фоне длительного применения иммуносупрессивнои терапии. У больных с гемобластозами при наличии хронической реакции трансплантат против хозяина значительно снижен риск развития рецидива основного заболевания по сравнению с пациентами, не имевшими этого осложнения (16 + 3 и 39 + 3 % соответственно), а 6-летняя безрецидивная выживаемость составляет 68 ± 4 и 54 ± 3 % соответственно.
Сравнительные результаты стандартного лечения и трансплантации стволовых клеток при гематологических заболеваниях (5-летняя безрецидивная выживаемость)
| Заболевания | Стандартное лечение | АлТКМ/АлСКК | АТКМ/АТСКК |
| Острый миелоидный лейкоз, первая ремиссия | 20-30% | 50-60% | 30-40% |
| Острый лимфобластный лейкоз, вторая ремиссия или первая ремиссия при наличии факторов риска | 10-20% | 40-50% | 30-40% |
| Хронический миелолейкоз, развернутая стадия (средняя выживаемость при химиотерапии — 48 месяцев) | 0% | 50-60% | — |
| Хронический миелолейкоз, фаза акселерации (средняя выживаемость при химиотерапии — 6 месяцев) | 0% | 20-30% | — |
| Агрессивные неходжкинские лимфомы, вторая ремиссия или первая ремиссия при наличии факторов риска | 10-20% | 40% | 30-50% |
| Лимфогранулематоз, вторая ремиссия или первая ремиссия при наличии факторов риска | 20% | применяется редко | 50-60% |
| Тяжелая апластическая анемия (средняя выживаемость при стандартном лечении — 6 месяцев) | 0% | 50-80% | — |
Противорецидивный эффект хронической реакции трансплантат против хозяина отмечен во многих исследованиях. При последовательном возникновении острой и хронической реакции трансплантат против хозяина меньше риск развития рецидива у больных с ОЛЛ и признаками «минимальной остаточной болезни» перед проведением алло-ТГСК. При ХМЛ хроническая реакция трансплантат против хозяина после алло-ТГСК развивалась чаще, что не оказывало влияния на общую выживаемость, тем не менее у пациентов без хронической реакции трансплантат против хозяина отмечено увеличение вероятности рецидива ХМЛ.
В зависимости от источника трансплантируемых клеток вероятность возникновения хронической реакции трансплантат против хозяина выше у больных после алло-ТПСКК, однако результаты ряда исследований это не подтверждают.
Распространенную форму хронической реакции трансплантат против хозяина наблюдали у 44 % пациентов после алло-ТПСКК и у 17 % больных после алло-ТКМ. При алло-ТПСКК потребность в повторном назначении иммуносупрессивной терапии была увеличена по сравнению с алло-ТКМ (39 и 5 % соответственно; р = 0,02). Несмотря на эти различия, 3-летняя общая и безрецидивная выживаемость не отличались у больных с гемобластозами после родственной алло-ТПСКК и алло-ТКМ.
На развитие хронической реакции трансплантат против хозяина оказывает влияние клеточный состав трансплантата. Так, повышенное содержание CD34+-клеток в трансплантате (более 8•106/кг) коррелировало с появлением признаков хронической РТПХ, но не оказывало влияния на общую выживаемость и рецидивы у больных с различными вариантами гемобластозов после алло-ТПСКК.
Эти данные не относятся к анализу развития хронической РТПХ после гаплоидентичной ТГСК. В таких случаях введение CD34+-клеток в количестве более 10•10б/кг не приводит к увеличению числа больных с хронической реакции трансплантат против хозяина, что может быть объяснено выполнением перед ТГСК Т-клеточного «истощения» трансплантата.
В отличие от острой РТПХ в развитии хронической реакции трансплантат против хозяина большую роль играют Th2-клетки. В связи с этим повышение вероятности развития хронической реакции трансплантат против хозяина после алло-ТПСКК можно объяснить индуцированным КСФ-Г увеличением активности Th2-клеток в трансплантате, которые в свою очередь мобилизуют Th2-индуцированные DC2 (dendritic cells) дендритные клетки. Поскольку хроническая реакция трансплантат против хозяина может быть ассоциирована с активностью Th2-клеток, существует вероятность, что хорошо реагирующие на КСФ-Г доноры развивают более глубокий ответ Th2- и DC2-клеток.
В большинстве случаев это не влияет на абсолютное повышение числа клеток CD3+ или CD14+ в трансплантате, но изменяет их функциональные свойства, что клинически проявляется в виде хронической РТПХ у реципиента. Таким образом, количественный состав клеток в ПСКК может не отражать его качественных характеристик. Необходимо учитывать, что реципиенты ПСКК, трансплантат которых содержит большое количество CD34+-клеток без Т-клеточного «истощения», получают повышенное содержание Th2- и DC2-клеток, что и приводит к более частому развитию у них хронической реакции трансплантат против хозяина.
В патогенезе хронической реакции трансплантат против хозяина, вероятно, имеют значение абсолютное количество иммунокомпетентных клеток, необходимое для запуска иммунологической реакции, и особенности клеточного состава трансплантата, полученного из КМ или ПСКК. Так, при сравнении стимулированных КСФ-Г клеток КМ и ПСКК возникновение хронической РТПХ отмечено у 22 % больных после алло-ТКМ с КСФ-Г стимулированным костным мозгом и у 80 % пациентов после алло-ТПСКК, что увеличивало необходимую длительность иммуносупрессивной терапии в последнем случае. После алло-ТПСКК по сравнению с алло-ТКМ восстановление у больных индекса Карновского до 90 % происходило медленнее (р = 0,08) и требовало более длительной госпитализации (р = 0,04).
Трансплантация ГСК пуповинной крови и аллоТГСК с применением Т-клеточного «истощения» сопровождаются низкой вероятностью развития хронической реакции трансплантат против хозяина. При гаплоидентичной алло-ТПСКК хроническая реакция трансплантат против хозяина наблюдается примерно у 10 % больных.
Лечение больных с хронической реакции трансплантат против хозяина проводят циклоспорином А в комбинации с глюкокортикоидами. Возможно сочетание этих препаратов с антилимфоцитарным иммуноглобулином, микофенолат-мофетилом (MMF, цельсепт). В настоящее время одним из основных методов терапии при хронической РТПХ является фотохимиотерапия — экстракорпоральное воздействие на кровь реципиента ультрафиолетовым излучением после предварительного приема препаратов, обладающих фотосенсибилизирующим эффектом (псорален). Механизм действия экстракорпорального облучения крови до конца неясен. Считают, что он может быть связан с индукцией апоптоза цитотоксических Т-лимфоцитов и созданием толерантности при развитии антигензависимого Т-клеточного ответа.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Трансплантат против хозяина что это
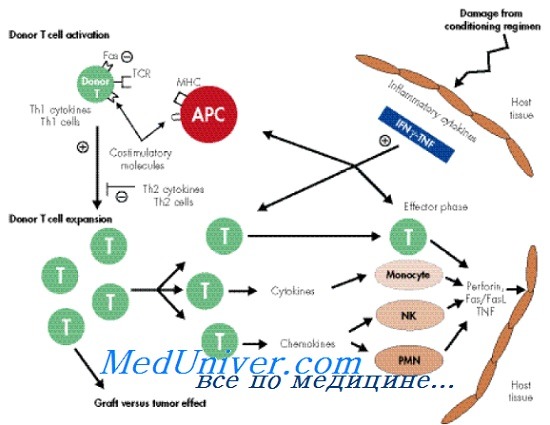
При алло-трансплантации гемопоэтических стволовых клеток наиболее грозным осложнением и одной из основных причин смерти остается острая РТПХ. В патогенезе этого осложнения лежат отсутствие полной совместимости клеток донора и реципиента по HLA-системе и реакция зрелых донорских Т-лимфоцитов на клетки реципиента.
Индукция острой реакции трансплантат против хозияина происходит в связи с высвобождением после назначения режимов кондиционирования клетками реципиента провоспалительных цитокинов: ИЛ-1, ИЛ-6, ИЛ-8, фактора некроза опухоли (ФИО). Это сопровождается экспрессией HLA-антигенов I и II классов, молекул адгезии на клетках реципиента и донора. Цитокины также индуцируют активацию трансплантированных Т-лимфоцитов и NK-клеток (естественные киллеры), что влечет за собой повреждение тканей реципиента и выделение цитокинов, активирующих Th1 (T helper 1)-лимфоциты (ИЛ-2, ИФу).
Частота и степень выраженности острой реакции трансплантат против хозияина зависят от возраста реципиента (реже встречается у детей), источника гемопоэтических стволовых клеток (КМ, ПСКК, пуповинная кровь), совместимости между донором и реципиентом по HLA-системе, режима кондиционирования, профилактики с помощью различных имму-нодепрессантов, варианта гемобластоза, способов деконтаминации кишечника.
В ряде исследований показано, что несовместимость по группе крови и полу пары донор — реципиент также увеличивает вероятность развития острой РТПХ. Наиболее часто острая РТПХ встречается при трансплантации от неродственного донора-женщины. Риск развития острой РТПХ ассоциируется с наличием у женщин «микрохимеризма» вследствие имевшихся ранее беременностей (длительная персистенция гемопоэтических стволовых клеток плода в организме матери), который может существовать до 40 лет после рождения ребенка. В то же время выполнение алло-трансплантации гемопоэтических стволовых клеток от сиблинга при наличии несовместимости по антигенам матери снижает вероятность возникновения острой РТПХ, что связано со взаимным обменом гемопоэтических стволовых клеток матери-плода и существованием у детей элементов взаимной иммунологической толерантности.
Данные о большей толерантности вследствие наличия «микрохимеризма» получены также при выполнении гаплоидентичной алло-ТГСК от донора-матери.
Острая реакция трансплантат против хозияина подразделяется на I, II, III и IV степени по отношению к интенсивности клинических проявлений и оценивается в соответствии с критериями Glucksberg и IBMTR Index.
Клинические проявления острой реакции трансплантат против хозяина (РТПХ):
— поражение кожи в виде сыпи, в более тяжелых случаях — разрушение эпидермиса, образование булл;
— нарушение функции желудочно-кишечного тракта (тошнота, рвота, диарея, боли в животе);
— поражение печени, сопровождающееся желтухой.
Безрецидивная и общая выживаемость больных, которым выполнили аутологичную трансплантацию костного мозга (ТКМ) или осуществляли химиотерапию
Обобщенные данные о вероятности развития острой реакции трансплантат против хозяина (РТПХ): после родственной алло-ТГСК 30—50 %, после неродственной алло-ТГСК 60—80 %, алло-ТГСК с Т-клеточным «истощением» 35—46 %, алло-ТГСК пуповинной крови 10 %, гаплоидентичной алло-ТПСКК 10-30 %.
Таким образом, вероятность развития острой реакции трансплантат против хозяина (РТПХ) после алло-ТГСК колеблется от 30 и 80 %, по данным ЕВМТ составляет 64,3 %, что связано с включением в исследование различных по своим характеристикам групп пациентов.
Необходимо отметить, что одними из основных факторов, имеющих значение в развитии острой реакции трансплантат против хозяина (РТПХ), являются источник трансплантата и его клеточный состав (КМ, ПСКК, пуповинная кровь, CD34+-клетки после Т-клеточного «истощения»), а также совместимость донора и реципиента по HLA-системе.
При сравнении вероятности развития острой реакции трансплантат против хозяина (РТПХ) при алло-ТКМ и алло-ТПСКК показано отсутствие определенных закономерностей. Однако ряд исследований подтверждает более частое возникновение острой реакции трансплантат против хозяина (РТПХ) после алло-ТПСКК. По данным других авторов, число острой и хронической реакции трансплантат против хозяина (РТПХ) после алло-ТКМ и алло-ТПСКК было одинаковым, при этом алло-ТКМ ассоциировалась с большей частотой развития тяжелой степени острой РТПХ (III—IV степень) по сравнению с алло-ТПСКК (24 и 8 % соответственно).
Очевидно, что возникновение острой реакции трансплантат против хозяина (РТПХ) у больных после алло-ТПСКК не доминирует по сравнению с алло-ТКМ, несмотря на явные различия в клеточном составе трансплантата. Это может быть связано с развитием цитокининдуцированной КСФ-Г поляризации Т-лимфоцитов в Th2 (T helper 2)-клетки при получении аллогенного трансплантата из ПСКК, в то время как в инициации острой реакции трансплантат против хозяина (РТПХ) в основном участвуют Th1-клетки. Эффект усиливается большим количеством в трансплантате из ПСКК дендритических клеток, которые главным образом также индуцируют ответ Th2-лимфоцитов и увеличенным содержанием моноцитов, подавляющих пролиферацию Т-лимфоцитов секрецией ИЛ-10.
В настоящее время получены противоречивые результаты в отношении влияния количества клеток CD34+ и CD3+ в трансплантате на развитие острой реакции трансплантат против хозяина (РТПХ) при алло-ТПСКК. Наиболее часто острая реакция трансплантат против хозяина (РТПХ) сопровождается появлением признаков приживления трансплантата, эозинофилией в крови и КМ. Повышенное содержание CD34+-клеток в трансплантате у больных после родственной алло-ТПСКК, коррелируя со скоростью приживления нейтрофилов и тромбоцитов, не увеличивало вероятности возникновения острой реакции трансплантат против хозяина (РТПХ). Количество клеток CD3+ и CD14+ или их отношение также не оказывали влияния на частоту возникновения этого осложнения. Это можно объяснить влиянием большого количества CD34+-клеток в трасплантате на клеточную популяцию Т-лимфоцитов, рассматриваемую как «вето» пролиферации.
Данные другого исследования предполагают возможное влияние дозы CD34+-клеток на развитие клинических проявлений острой РТПХ. Так, риск возникновения острой РТПХ зависел от способа профилактики при дозе CD34+-клеток в трансплантате менее 8 • 106/кг. Острая РТПХ развивалась реже при использовании такролимуса, а не циклоспорина А — соответственно в 18 и 39 % случаев. При концентрации CD34+-клеток более 8 • 106/кг выбор им-муносупрессивной терапии не имел принципиального значения.
Прямая зависимость возникновения острой реакции трансплантат против хозяина от содержания CD34+-клеток установлена у больных после родственной алло-ТПСКК с Т-клеточным «истощением». Так, при концентрации CD34+-клеток менее 2 • 106/кг острая РТПХ I—IV степени возникла у 21 % больных, от 2 до 4 • 106/кг — у 35 %, более 4 • 106/кг — у 43 % больных (р = 0,01).
Клинические и экспериментальные данные подтверждают, что удаление Т-лимфоцитов из трансплантата значительно снижает вероятность развития острой реакции трансплантат против хозяина (РТПХ). Минимальное количество CD3+ T-лимфоцитов в трансплантате, необходимое для индукции острой реакции трансплантат против хозяина (РТПХ), колеблется от 0,5 до 1 • 106/кг. Дозы CD3+-клеток от 0,05•106/кг и менее, от 0,05 • 10б/кг до 0,1 • 106/кг и более чем 0,1 • 106/кг сопровождаются риском развития острой реакции трансплантат против хозяина (РТПХ) I—IV стадии у 18, 35 и 44 % больных соответственно (р = 0,007). При анализе на основании Сох regression model в этом исследовании для развития острой РТПХ I—IV стадии имели значение четыре независимых фактора: 1) увеличение дозы CD34+-клеток (р = 0,02); 2) увеличение дозы CD3+-клеток (р = 0,02); 3) женский пол реципиента (р = 0,01); 4) возраст реципиента старше 2 лет (р = 0,007).
При сравнении вероятности развития острой реакции трансплантат против хозяина у больных после неродственной алло-ТКМ с/без Т-клеточного «истощения» не установлено различия в частоте ее возникновения.
Таким образом, окончательное заключение о значении клеточных взаимодействий в развитии острой реакции трансплантат против хозяина (РТПХ) после алло-ТГСК может быть определено в будущем, после проведения экспериментальных и клинических рандомизированных исследований.
При анализе факторов, индуцирующих развитие острой реакции трансплантат против хозяина (РТПХ), установлено влияние возраста и стадии болезни. После алло-ТГСК при ХМЛ меньше вероятность развития острой реакции трансплантат против хозяина (РТПХ) и ниже степень у молодых больных и пациентов, которым трансплантация была выполнена в первый год с момента постановки диагноза. Пол донора и реципиента, источник трансплантата, метод профилактики острой реакции трансплантат против хозяина (РТПХ) не имели какого-либо значения.
Основу профилактики острой реакции трансплантат против хозяина (РТПХ) составляют препараты циклоспорин А, такролимус (FK506) и их сочетание с другими иммунодепрессантами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Трансплантат против хозяина что это
Приживление трансплантата может сопровождаться хронической РТПХ. Обычно она развивается через 100 дней после трансплантации, но иногда и на 60-й день. Вероятность развития хронической реакции трансплантат против хозяина (РТПХ) после трансплантации кроветворных стволовых клеток (ТКСК) от HLA-идентичных сибсов составляет 24 %, а после неродственной ТКСК— 37%. Патогенез хронической РТПХ недостаточно выяснен, но, по-видимому, в нем принимают участие аллореактивные донорские Т-лимфоциты вместе с предшественниками Т-лимфоцитов реципиента, которые из-за аберрантной селекции в тимусе остались аутореактивными.
Хроническая реакция трансплантат против хозяина (РТПХ) напоминает мультисистемные аутоиммунные заболевания, имитируя отдельные проявления синдрома Шегрена (сухость глаз и слизистой оболочки полости рта), СКВ и склеродермии, красного плоского лишая, облитерирующего бронхиолита и первичного билиарного цирроза печени. Часто возникают инфекции (сепсис, синуситы, пневмонии), вызываемые инкапсулированными бактериями, грибами и вирусами. Это во многом определяет связанные с трансплантацией кроветворных стволовых клеток (ТКСК) заболеваемость и смертность. Профилактическое введение триметоприм/сульфаметаксазола снижает частоту пневмонии, вызываемой Pneumocystis carinii.
Риск хронической реакции трансплантат против хозяина (РТПХ) возрастает с увеличением возраста донора или реципиента, после острой реакции трансплантат против хозяина (РТПХ), при введении донорских лимфоцитов, а также при использовании клеток от многорожавших доноров. В лечении хронической реакции трансплантат против хозяина (РТПХ) дополнительно используют иммуносупрессивные средства, главным образом преднизон и циклоспорин, что, в свою очередь, способствует развитию инфекционных заболеваний. Обширные поражения кожи, тромбоцитопения (число тромбоцитов менее 100 000 в 1 мкл) и быстрое развитие реакции значительно ухудшают прогноз.
Для профилактики и лечения отторжения аллотрансплантатов и реакции трансплантат против хозяина (РТПХ) используют иммунносупрессивные средства. Поскольку отторжение аллотрансплантата обусловлено активацией Т-лимфоцитов реципиента (вследствие отличия его HLA от антигенов донора), без иммуносупрессии можно обойтись лишь при трансплантации тканей от однояйцовых близнецов, а также при некоторых тяжелых иммунодефицитах у реципиента. Трансплантация внутренних органов требует пожизненной иммуносупрессии, тогда как реципиенты стволовых клеток должны получать иммунодепрессанты в течение 6-12 мес, пока не произойдет приживление аллотрансплантата.
Специальный отбор стволовых клеток и Т-лимфоцитов донора исключает реакцию трансплантат против хозяина (РТПХ) и позволяет применять более мощные иммунодепрессанты, а это, в свою очередь, делает возможным трансплантацию от менее совместимых доноров. Идеальный иммунодепрессант должен подавлять активность не только лимфоцитов реципиента, обусловливающих отторжение, но и лимфоцитов донора, от которых зависит развитие реакции трансплантат против хозяина (РТПХ). В то же время он не должен нарушать иммунные реакции против инфекционных агентов и опухолевых клеток (т. е. реакцию «трансплантат против опухоли»).
Трансплантат против хозяина что это
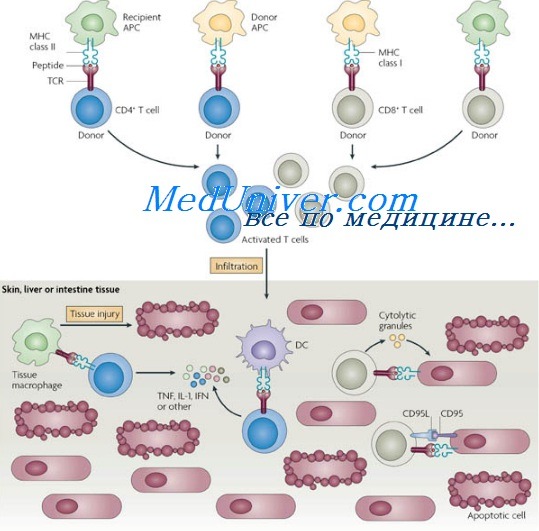
Т-лимфоциты донора при попадании в организм больного с нарушенным иммунитетом (вследствие врожденных причин, облучения или химиотерапии) могут активироваться HLA реципиента и индуцировать реакцию трансплантат против хозяина (РТПХ). Гибель клеток реципиента обусловлена цитотоксической активностью клеток донора (например, NK-клеток) и действием лим-фокинов (например, ФНО), выделяемых активированными лимфоцитами. Необходимые условия развития РТПХ включают присутствие иммуно-компетентных клеток в трансплантате, ослабление иммунитета реципиента и отсутствие реакции против трансплантата, HLA которого отличаются от таковых реципиента.
Различают острую (развивающуюся не позднее, чем через 100 дней после трансплантации кроветворных стволовых клеток (ТКСК)) и хроническую (более позднюю) реакцию трансплантат против хозяина (РТПХ). При этом может возникать эффект «трансплантат против опухоли», снижающий риск рецидива при лейкозе. В случаях злокачественных заболеваний рассчитывают именно на такой эффект РТПХ, что позволяет использовать низкодозовые (немиелоаблативные) режимы кондиционирования. Достаточная для приживления донорских клеток иммуносупрессия обеспечивает возможность уничтожения клеток опухоли. РТПХ отражает потерю «толерантности», которая в норме обусловлена элиминацией аллореактивных лимфоцитов в тимусе, модуляцией рецепторов Т-клеток, анергией аллореактивных клеток и Т-супрессорами.
Острая реакция трансплантат против хозяина (РТПХ) возникает вследствие выделения воспалительных цитокинов (ИФН, ИЛ, ФНО) клетками реципиента, поврежденными предшествующими воздействиями (режимом кондиционирования). АПК реципиента представляют измененные собственные антигены донорским Т-лимфоцитам в богатой цитокинами среде, что приводит к активации и пролиферации донорских Т-клеток. Активированные CD4 и CD8 донорские Т-лимфоциты выделяют дополнительное количество цитокинов («цитокиновая буря»); в результате активируются цитотоксические Т-лимфоциты и NK-клетки, вызывающие гибель клеток и тканей реципиента.
Клинически острая реакция трансплантат против хозяина (РТПХ) характеризуется эритродермией, внутрипеченочным холестазом и энтеритом.
В типичных случаях сразу же после трансплантации кроветворных стволовых клеток (ТКСК) возникает зудящая пятнисто-папулезная сыпь на ушах, ладонях и ступнях. В дальнейшем она может распространяться на туловище и конечности, становясь сливной, бул-лезной и эксфолиативной. Лихорадка возникает не всегда. Острую РТПХ следует отличать от токсических проявлений режимов кондиционирования, лекарственной сыпи, а также вирусных и иных инфекционных экзантем. Нарушения функции печени проявляются холестатической желтухой с повышением уровня печеночных ферментов в крови. Дифференциальную диагностику проводят с гепатитом, веноокклюзивной болезнью печени или лекарственными эффектами. Кишечные симптомы острой РТПХ (схваткообразная боль в животе и понос, часто с примесью крови) сходны с симптомами, связанными с режимом кондиционирования или инфекцией.
Могут иметь место эозинофилия, лимфоцитоз, энтеропатия с потерей белка, аплазия костного мозга (нейтропения, тромбоцитопения, анемия). Развитию острой реакции трансплантат против хозяина (РТПХ) способствуют различия донора и реципиента по HLA, неправильный подбор донора по полу и возрасту, наличие родов в анамнезе донора, проведение ТКСК в активной фазе или при рецидиве лейкоза, а также чересчур высокие дозы облучения реципиента. Для профилактики и лечения РТПХ применяют различные иммуносупрессивные средства. РТПХ может возникать после переливания компонентов крови больным с относительно подавленным иммунитетом, включая перенесших ТКСК или иммуносупрессивную противораковую терапию, ВИЧ-инфицированных, страдающих врожденным иммунодефицитом и недоношенных детей. Поэтому переливаемую кровь в таких случаях необходимо предварительно облучать (25-50 Гр); бесклеточные компоненты крови (свежезамороженная плазма или криопреципитат) не требуют облучения.