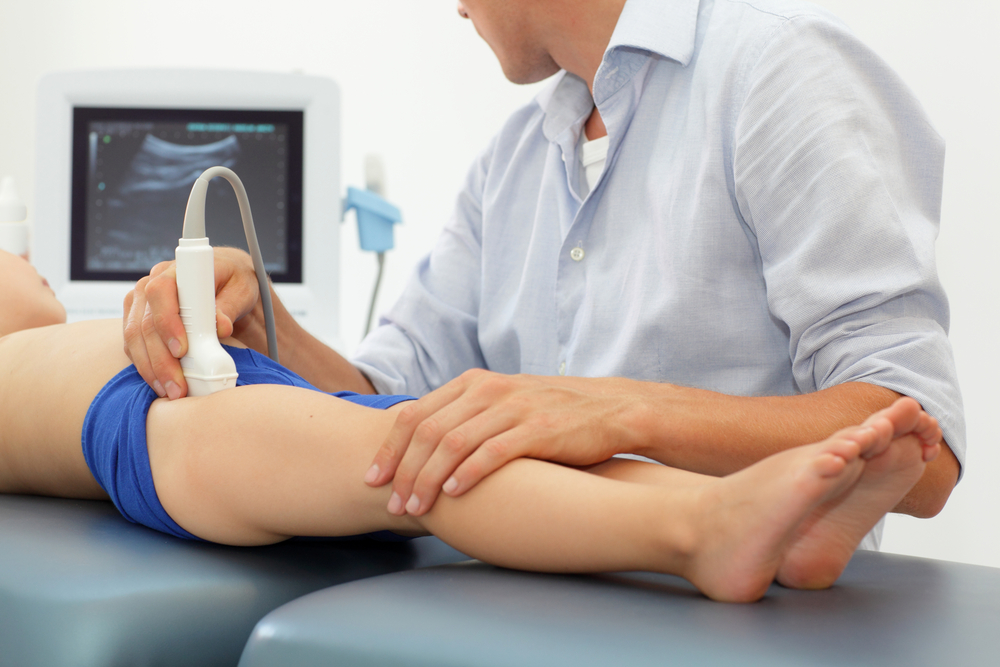
Трабекулярный отек костного мозга тазобедренного сустава что это
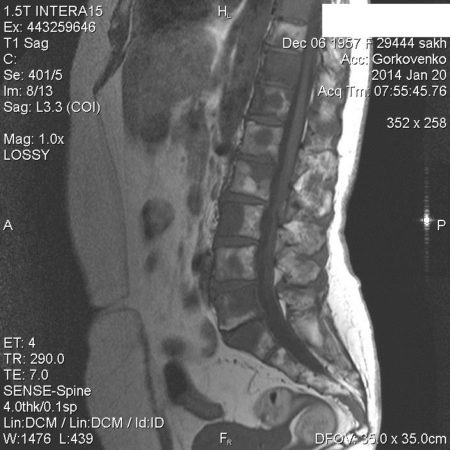
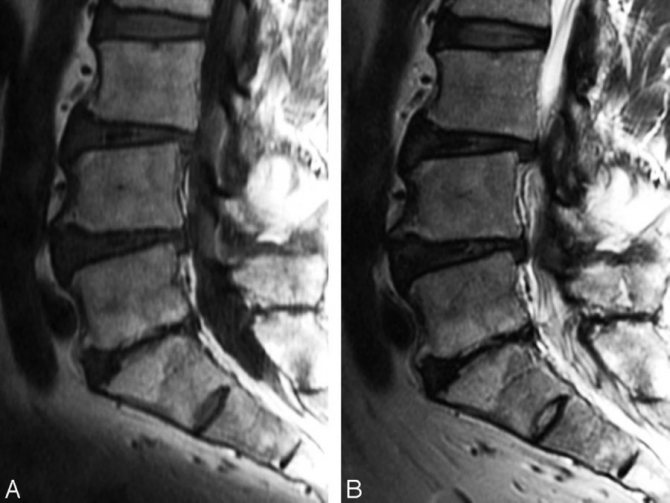
Отек костного мозга на МРТ позвоночника
Боли в спине – одна из самых распространенных причин обращения людей к врачу. Благодаря современным высокотехнологическим исследованиям врач может определить характер патологии, локализацию, размеры, выработать план лечения.
МРТ регистрирует отклик атомов водорода в тканях человека на сильное магнитное поле, на снимках ткани визуализируются по-разному в зависимости от содержания в них воды. Поэтому можно обнаружить изменения структуры костного мозга и его отек на МРТ позвоночника.
Причины отека костного мозга
Костный мозг расположен внутри тела каждого позвонка. Между трабекулами кости располагаются стволовые клетки, рыхлая соединительная ткань, жировая ткань. Здесь образуются все клетки крови – эритроциты, лейкоциты, тромбоциты. Поэтому изменения в костном мозге сопровождаются анемией, снижением иммунитета, обострением аутоиммунных заболеваний, склонностью к кровотечениям. С возрастом жировые клетки замещают большую часть костного мозга.
Причину отека помогает выявить опрос пациента. Большое значение имеет предшествующая травма, характер и длительность боли, нарушения чувствительности кожи, сопутствующие заболевания.
Травматический отек
Наиболее частой причиной его возникновения является травма спины: человек упал или ударился, боль со временем не проходит. Характерная особенность боли – она локализована выше, чем травмированное место. Это связано с тем, что отекший позвонок сдавливает спинномозговые корешки, сами нервы выходят из спинного мозга выше и какое-то время следуют внутри позвоночного канала, затем покидают его через межпозвоночные отверстия.
Трабекулярный отек сопровождает травмы в 100 % случаев. Встречается в любом отделе позвоночника – от шейного до копчика, локализация зависит от механизма травмы. Под действием механического фактора увеличивается давление на костную ткань, может произойти перелом позвонка, растяжение и разрывы связок. Кровеносные сосуды повреждаются, жидкая часть крови и клетки выходят из сосудов и заполняют место между костными балками. Симптоматическое лечение временно облегчает состояние, но без прицельного воздействия на причину отека костного мозга вылечиться невозможно.
Вторичный отек кости
Вторичные отеки не связаны с травмой, они осложняют течение других патологических процессов:
Отек спинного мозга часто сопровождает воспалительные процессы в позвоночнике (остеомиелит, туберкулез). Микробы могут попадать в тела позвонков с кровью из любого очага хронической инфекции (кариес, тонзиллит, эндокардит).
Дегенеративные явления (остеохондроз, межпозвоночные грыжи, артрозы фасеточных суставов – соединений между двумя соседними позвонками) нарушают питание кости, приводят к отеку. При первичном очаге в хряще отек сначала субхондральный, то есть под хрящом, далее распространяется на остальную костную ткань.
Опухоли сдавливают окружающие ткани, приводят к нарушению кровоснабжения кости, что проявляется в виде перифокального отека костного мозга позвоночника, то есть вокруг новообразования.
Нарушения обмена, эндокринные заболевания, хроническая патология почек, расстройства пищеварения ведут к дисбалансу электролитов, накоплению ионов натрия, могут стать причиной развития метаболического отека кости.
Ятрогенные причины: после операций на позвоночнике (реактивный отек), в результате приема некоторых лекарств (стероидных гормонов), на фоне лучевой терапии.
Отек костного мозга, что покажет МРТ позвоночника?
Из-за скопления жидкости в костной ткани тела позвонков увеличивается в размерах, приобретают раздутую форму. Если они увеличиваются настолько, что начинают сдавливать спинной мозг, проходящий в канале позвоночного столба, появляются неврологические симптомы, на снимках видны структурные изменения спинномозговых корешков и спинного мозга. Это уже очень опасно, развиваются:
Двигательные и чувствительные нарушения в нижних конечностях, если поражен поясничный отдел позвоночника, появляются нарушения работы тазовых органов (нарушение мочеиспускания, дефекации, половые расстройства).
При поражении шейного отдела позвоночника страдает иннервация рук (изменяется чувствительность, ограничение движений). При сильном отеке спинной мозг сдавливается не только на уровне шеи, нарушение кровообращения распространяется в вышележащие отделы. Могут присоединиться нарушения зрения, головные боли, менингеальные симптомы, рвота, повышение внутричерепного давления из-за отечности и сдавления нервов, мозговых оболочек. В продолговатом мозге расположены жизненно важные центры – дыхания и сердечной деятельности. Вовлечение их в патологический процесс может привести к летальному исходу.
Отек спинного мозга, нервов, оболочек мозга характеризуется повышением интенсивности сигнала по сравнению со здоровыми тканями. При гидроцефалии расширяются желудочки мозга.
Как выглядит отек костного мозга на МРТ?
На снимках МРТ отек костного мозга выглядит как очаг внутри кости большей интенсивности с размытыми однородными контурами. Само тело позвонка увеличено, несколько размыты границы. В норме содержание жидкости в кости до 10 %. При отеке эта цифра увеличивается до 20 %. Под действием магнитного поля можно определить концентрацию атомов водорода в тканях, границы отека, какие структуры кроме костного мозга вовлечены. Это особенно ценно, так как другие методы – рентген, КТ не выявляют отек костного вещества, микротрещины. На них визуализируются более значительные повреждения – перелом, остеопороз, трещина, смещение, некроз.
На МРТ, когда отекает костная ткань, выявляют гиперинтенсивность костного мозга. Впервые явление было зафиксировано Уилсоном в 1988 году, получило название отек костного мозга. Некоторые рассматривают его как первую, обратимую стадию развития остеонекроза. Обычно эту формулировку используют как клинико-радиологический синдром для уточнения основного заболевания. И только при исключении всех возможных других патологий ставят диагноз отек костного мозга. Для дифференциальной диагностики назначают МСКТ с контрастом, МРТ с контрастом, рентген, определение онкомаркеров в крови, ревматоидного фактора, пункцию с последующей биопсией костного мозга.
После определения с диагнозом выбирают лечение.
МРТ – единственное исследование, которое выявляет отек костного мозга позвоночника. Кроме того, на снимках видно состояние всех мягких тканей по соседству – нервов, связок, мышц, кровеносных сосудов, визуализируются грыжи на начальных стадиях. Это очень ценная информация, позволяющая выбрать правильное лечение: кому-то необходима срочная операция, кому-то – антибиотики, гормональное лечение, сосудистые средства, мочегонные, бисфосфонаты, препараты кальция, ингибиторы простагландина, витамин Д, ношение корсета. Клинически многие болезни проявляются болью в спине, а лечение требуется всем разное. Выбрать правильное направление помогает именно МРТ.
Костно-мышечные нарушения в практике интерниста — диагностика, подходы к лечению
В статье представлены основные подходы к диагностике и лечению таких заболеваний костно-мышечной системы, как остеоартроз, боль в спине, периартикулярная патология. Отражены принципы нелекарственной и медикаментозной терапии.
The article presents main approaches to the diagnosis and treatment of diseases of the musculoskeletal system like osteoarthritis, back pain, periarticular pathology. The principles of non-pharmacological and pharmacological therapy were reflected.
Костно-мышечные нарушения широко распространены и встречаются во всех возрастных группах населения. Подавляющее большинство пациентов составляют лица среднего и пожилого возраста. Ведущей жалобой являются боли в суставах и спине, связанные с физической нагрузкой, появляющиеся и/или усиливающиеся во второй половине дня/первой половине ночи, уменьшающиеся в покое, при этом локальные и системные признаки воспаления выражены незначительно.
Типичными представителями группы костно-мышечных заболеваний являются остеоартроз (ОА), периартикулярная патология (энтезиты, бурситы, тендиниты и др.), неспецифическая боль в нижней части спины (БНС).
ОА — мультифакториальное заболевание, развитию которого способствуют генетические факторы, ожирение, гиподинамия, микротравматизация суставов, избыточные физические усилия, а также «большие» травмы суставов [1]. Согласно определению Международного общества по изучению остеоартрита (The Osteoarthritis Research Society International, OARSI) 2005 г., ОА — это расстройство с вовлечением подвижных суставов, характеризующееся клеточным стрессом и деградацией экстрацеллюлярного матрикса, инициируемых микро- и макроповреждением, которые активируют неадекватные восстановительные ответы, включая провоспалительные пути иммунной системы [2].
В настоящее время описаны несколько фенотипов ОА [3].
ОА представляет гетерогенную группу заболеваний различной этиологии, при которых в процесс вовлекается не только суставной хрящ, но и субхондральная кость, связки, суставная капсула, синовиальная оболочка и периартикулярные мышцы.
Прогрессирование ОА — следствие взаимодействия механических, биологических, биохимических и молекулярных факторов, нарушающих нормальный цикл синтеза и деградации хондроцитов суставного хряща, компонентов внеклеточного матрикса (ВМ) и субхондральной кости. В нормальном хряще существует баланс между синтезом и деградацией составляющих ВМ, тогда как при ОА динамическое равновесие нарушается в результате потери коллагена II типа. Помимо нарушений метаболизма хряща, изменений субхондральной кости в патогенезе ОА большая роль отводится воспалению. Воспалительный процесс затрагивает практически все структуры сустава с формированием хондрита, синовита и остеита [4].
Взаимодействия цитокинов, ферментов, продуктов распада матрикса приводят к уменьшению содержания протеогликанов в хряще, нарушению архитектоники матрикса, появлению микротрещин и надрывов хряща. Эти процессы могут усиливаться при прорастании в хрящ сосудов микроциркуляторного русла. В воспалительный процесс вовлекаются синовиальная оболочка и субхондральная кость. На этом этапе возможно появление боли. Поскольку хрящ не иннервируется, боль является признаком вовлечения в патологический процесс периартикулярных тканей. Кроме того, источниками боли при ОА могут быть также синовит, трабекулярные микропереломы, давление на обнаженную субхондральную кость, формирование остеофитов, повышение внутрикостного давления в связи с венозным застоем, спазм близлежащих мышц, дегенеративные изменения связок [4].
Одной из наиболее значимых и инвалидизирующих форм ОА является гонартроз. Его основным симптомом является боль механического типа, возникающая при ходьбе и особенно при спуске или подъеме по лестнице. Боли локализуются в передней или внутренней частях сустава и могут иррадиировать в голень. Основное место отводится оценке болевого синдрома при ОА, клиническая палитра которого обусловлена различными его патогенетическими вариантами:
В качестве диагностических критериев ОА коленного сустава, в наибольшей мере отражающих клинические представления об этом заболевании, используются критерии M. Lequene:
Диагноз устанавливается при наличии всех трех признаков и исключении таких заболеваний, как ишемический некроз кости, костная болезнь Педжета, хондрокальциноз (пирофосфатная артропатия), гемохроматоз, охроноз, гемофилия, артриты, инфекции сустава (в т. ч. туберкулез), сустав Шарко (нейроартропатия), пигментный виллезонодулярный синовит, хондроматоз [4].
На современном этапе описаны факторы прогрессирования ОА:
У 85% больных ОА, согласно морфологическим данным, определяются воспалительные изменения в области «синовиоэнтезиального комплекса», что свидетельствует о тесной связи между синовией и периартикулярными структурами [5]. При описании периартикулярной патологии обычно используют следующие термины:
Бурсит — воспаление синовиальных сумок преимущественно в области суставов (субакромиальный, локтевого отростка, вертельный, препателлярный, сумки гусиной лапки (анзериновый)).
Тендинит — воспаление сухожилия (тендинит) и его влагалища (теносиновит) (двуглавой, надостной мышц, пяточного (ахиллового) сухожилия, инфрапателлярный).
Энтезопатия/энтезит — воспаление в местах прикрепления сухожилий, фасций, связок к костям, чаще всего в местах апофизов, бугристостей, мыщелков, отростков (латеральный и медиальный эпикондилиты).
Основные причины периартикулярной патологии (тендинитов и энтезитов):
Характерными клиническими особенностями периартикулярного поражения являются боль при определенных движениях и ее локальный характер (пациент указывает точку максимальной боли), уменьшение объема активных при сохранении объема пассивных движений, асимметрия сустава, связь отечности с конкретной бурсой, сухожильным влагалищем.
Анзериновый тендинит/бурсит (pes anserinus — место прикрепления к большеберцовой кости сухожилий портняжной (m. sartorius), тонкой (m. gracilis) и полусухожильной (m. semitendinosus) мышц. Анатомически находится на 3–4 см ниже проекции щели коленного сустава по медиальной его поверхности). Факторами риска развития тендинита являются спортивные нагрузки (бег), остеоартрит, разрыв мениска, ожирение, длительная ходьба, внезапное увеличение нагрузок на ноги, плоскостопие, сахарный диабет.
Для анзеринового тендинита характерны боль при подъеме по лестнице (при гонартрозе — усиление боли при спуске), лежа на боку, при укладывании одного колена на другое. Больной указывает на болезненную точку, соответствующую расположению анзериновой сумки, при пальпации отмечается выраженная болезненность и припухание (реже) в «заинтересованной» зоне.
Тендинит/бурсит большого вертела (трохантерит) — развивается чаще у женщин в возрасте 40–60 лет, страдающих ОА тазобедренного сустава. Для трохантерита характерна глубокая, жгучая боль по латеральной поверхности сустава и бедра, возрастающая при ходьбе по ровной поверхности и подъеме по лестнице, сидении на корточках, которая сочетается с хромотой у части больных. Постоянный характер боли указывает на вертельный бурсит. Снижение интенсивности боли отмечается в покое, усиливается по ночам, лежа на больной стороне. При осмотре отсутствуют ограничения пассивных и активных движений в тазобедренном суставе, отмечается локальная болезненность в зоне большого вертела при пальпации, при сопротивлении активному отведению бедра возникает боль.
Неспецифическая БНС является универсальной моделью костно-мышечных нарушений у пациентов всех возрастных групп, включающей поражение мышц, связок, суставного аппарата позвоночника. В появлении острой БС важную роль играет локальное повреждение связочного аппарата позвоночного столба, прежде всего коротких связок (желтых, межпоперечных и межостистых), стабилизирующих позвоночник на сегментарном уровне на фоне нефизиологических движений и чрезмерной нагрузки. Развитие мышечной дисфункции, энтезопатий, тендопатий вовлеченных мышц, сочетающихся с ОА дугоотростчатых суставов, спондилезом, лежит в основе развития хронической БС, при этом поддержание болевого синдрома у части больных обусловлено развитием феноменов периферической и центральной сенситизации (рис.) [5].
Миофасциальная дисфункция (миофасциальный синдром, МФС), ассоциированная с физической или позной нагрузкой, характеризуется формированием плотных болезненных тяжей и участков повышенной чувствительности (триггерных точек, ТТ) в пределах пораженной мышцы с воспроизведением паттерна отраженной боли или чувствительных расстройств (парестезий) при пальпации, а также ограничением объема движений.
МФС квадратной мышцы поясницы сопровождается болью в поясничной области глубинного характера с иррадиацией в крестцово-подвздошное сочленение и ягодичную область, при глубоком расположении ТТ — в бедро, область гребня подвздошной кости и паховую область. Формирование ТТ в квадратной мышце поясницы происходит при форсированных движениях, сопровождающихся наклоном и поворотом туловища, подъемом груза, а также при позном напряжении, связанном с садовыми работами. Болевые ощущения в поясничной области возникают и усиливаются при ходьбе, наклонах туловища, поворотах в постели, вставании со стула, кашле, чихании. Наиболее интенсивный характер боль приобретает в горизонтальном положении. Для выявления ТТ необходима глубокая пальпация в положении пациента лежа на здоровом боку. При выполнении наклона туловища в сторону, противоположную локализации спазмированной мышцы, болевой синдром усиливается [6].
МФС грушевидной мышцы характеризуется ноющими, тянущими, мозжащими болями в ягодичной области, в области крестцово-подвздошного сочленения, тазобедренного сустава и по задней поверхности больной ноги. Болевые феномены усиливаются после длительного сидения, в начале ходьбы, в положении стоя, полуприседании на корточках, при попытке приведения бедра. Уменьшение болей происходит в положении лежа, сидя с разведенными ногами, в процессе непродолжительной ходьбы. Объем движений в поясничном отделе позвоночника не изменен, поднимание прямой ноги часто ограничено. ТТ в грушевидной мышце наиболее часто активируются при движениях, связанных с форсированной ротацией на одной ноге, падениях, при длительном отведении ног в тазобедренных и сгибании в коленных суставах во время акушерских и урологических манипуляций.
Боль при спондилоартрозе локализуется в паравертебральной области, носит односторонний или двусторонний характер, может иррадиировать в ногу до уровня колена. Болевой синдром возникает после эпизодов длительной неподвижности, усиливается при разгибании, уменьшается при сгибании и движении, неврологические нарушения не характерны. Переразгибание позвоночника или сочетание разгибания с ротацией провоцирует боль (положительный тест Кемпа) [7].
Скрининговую оценку состояния опорно-двигательного аппарата (GALS — Gait — походка, Arm — рука, Leg — нога, Spine — позвоночник) рекомендуется проводить, учитывая следующие анамнестические сведения [8]:
В диагностике заболеваний суставного аппарата важное значение имеет оценка признаков непосредственного поражения сустава и периартикулярной патологии. В первом случае боль носит постоянный характер, присутствует в покое, усиливается при движении, сопровождается уменьшением объема как активных, так и пассивных движений, при объективном осмотре определяется выпот в суставе (реактивный синовит при ОА), утолщение синовиальной оболочки, интраартикулярный хруст.
Лечебная тактика при ОА, периартикулярной патологии, неспецифической БНС сводится к купированию болевого синдрома в максимально короткий срок с использованием нестероидных противовоспалительных препаратов (НПВП), оценка эффективности которых проводится через 7–14 дней от начала приема полной терапевтической дозы, предпочтителен пероральный способ применения. Для кратковременного лечения очень интенсивной острой боли и/или при невозможности перорального приема рекомендуется использование инъекционных форм НПВП продолжительностью не более трех дней. При слабой или умеренно выраженной боли, высоком риске осложнений при системном приеме НПВП применяются локальные формы НПВП (мази, гели, спреи) [5].
Алгоритм ведения пациентов с ОА включает соблюдение рекомендаций по снижению веса, сбалансированному питанию, лечебной физкультуре. При наличии реактивного синовита показан охранительный режим до купирования воспаления. Для сдерживания прогрессирования ОА показано курсовое применение базисной терапии (симптом-модифицирующие препараты замедленного действия). В качестве физиотерапевтического лечения используются бальнеотерапия, ультразвуковая терапия, магнитотерапия, электрофорез с глюкокортикостероидами (ГКС).
При наличии периартикулярного поражения рекомендуется ограничить активные движения с участием вовлеченных структур в течение 2–3 недель. Проводится периартикулярное введение ГКС при неэффективности НПВП, физиотерапевтические процедуры (фонофорез, электрофорез, криотерапия, магнитные токи, бальнеотерапия), лечебная физкультура. Локальные инъекции ГКС проводятся при наличии локального воспаления в области четко определенной анатомической структуры и отсутствии эффекта при использовании НПВП в течение как минимум 7–14 дней. Интервал между введениями ГКС должен составлять 2–3 недели, показано не более трех инъекций в одну область в течение 12 месяцев [5].
При неспецифической БНС постельный режим должен быть ограничен 72 часами. Медикаментозная терапия в остром периоде может носить многокомпонентный характер (НПВП, миорелаксанты коротким курсом до 10 дней, анальгетики). При наличии МФС предпочтение отдается назначению миорелаксантов, применению мануальных миорелаксирующих методик. Рекомендуется еженедельная оценка состояния при острой БНС или обострении хронической БНС. Коррекция тактики ведения (в т. ч. консультация невролога) при ее неэффективности проводится через 4–6 недель (при хроническом варианте течения — ежемесячный осмотр) [9].
Приоритет в терапии ОА отдается лекарственным средствам замедленного симптоматического действия (SYSADOA — Symptomatic Slow-Acting Drugs for Osteoarthritis). Последние характеризуются природным происхождением, наличием достоверных данных о клинической эффективности и низкой частотой нежелательных эффектов. В лечении ОА используют хондроитин сульфат, глюкозамин, неомыляемые соединения сои и авокадо, диацереин, гиалуроновую кислоту.
В клинической практике на протяжении нескольких десятилетий широко используется многокомпонентный препарат замедленного симптоматического действия, демонстрирующий высокую клиническую эффективность и безопасность, — Алфлутоп — стандартизированный раствор для инъекций на основе биоактивного концентрата из мелкой морской рыбы. В состав препарата входят сульфатированные глюкозаминогликаны, аналогичные матриксу гиалинового хряща: хондроитин-4-сульфат, хондроитин-6-сульфат, дерматансульфат, кератансульфат, глюкуроновая кислота, свободные аминокислоты, макро- и микроэлементы (натрий, калий, кальций, магний, железо, медь, цинк) (табл.).
Согласно новым экспериментальным данным, полученным in vitro, Алфлутоп демонстрирует патогенетический механизм действия при ОА.
Механизм действия препарата Алфлутоп:
Кроме того, в экспериментальных исследованиях на стандартизированной клеточной линии нормальных костных хондроцитов человека (CHON-001) доказано хондрорепаративное действие препарата Алфлутоп. Изучались пролиферативный статус (показателен для динамической клеточной регенерации) и внеклеточное высвобождение трансформирующего фактора роста бета (ТФР-β) — ключевого белка в гомеостазе внеклеточного матрикса. В ходе исследования Алфлутоп продемонстрировал активацию ТФР-β и улучшение клеточного пролиферативного индекса более чем на 50% по сравнению с контрольными клетками; препарат стимулирует синтез дезоксирибонуклеиновой кислоты и митоз хондроцитов, этот эффект носит дозозависимый характер [10].
Препарат Алфлутоп имеет широкий спектр клинической доказательной базы. С участием сотрудников кафедры факультетской терапии им. акад. А. И. Нестерова РНИМУ им. Н. И. Пирогова проведено двухлетнее многоцентровое слепое рандомизированное плацебо-контролируемое клиническое исследование по изучению симптом- и структурно-модифицирующего действия препарата Алфлутоп при гонартрозе [11]. В исследование были включены 90 больных ОА коленного сустава второй и третьей стадий по классификации Kellgren–Lawrence. Пациентов рандомизировали на две группы по 45 человек в каждой: первая получала внутримышечные инъекции Алфлутопа по 1 мл курсами по 20 дней с интервалом шесть месяцев в течение двух лет (всего четыре курса), вторая — инъекции плацебо (изотонический раствор натрия хлорида) по аналогичной схеме. В качестве сопутствующей терапии назначался ибупрофен в дозе 600–1200 мг/сут. Различия в абсолютной величине снижения интенсивности боли по индексу выраженности остеоартрита университетов Западного Онтарио и МакМастера (Western Ontario McMaster Universities OA Index — WOMAC) между группами оказались достоверными. Достоверное снижение скованности в группе Алфлутопа наблюдалось к третьему визиту (p
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
* Курс лечения целесообразно повторить через шесть месяцев.
Костно-мышечные нарушения в практике интерниста – диагностика, подходы к лечению/ Н. А. Шостак, Н. Г. Правдюк
Для цитирования: Лечащий врач №12/2017; Номера страниц в выпуске: 68-73
Теги: болевой синдром, суставы, позвоночник, миофасциальный синдром
Трабекулярный отек костного мозга тазобедренного сустава что это
Остеохондропатия головки бедренной кости (болезнь Пертеса—Легга—Кальве)
Заболевание выделено как самостоятельное A. Legg (1909), G. Perthes (1910), J. Calve (1916), и с тех пор его называют именами данных авторов. Среди всех остеохондропатий оно составляет от 0,17 до 17% [Шапиро М. Н., Цыпкин Б. Н., 1935; Низовская М. М., Грацианский В. П., 1940], а среди заболеваний суставов — до 25,3% [Крылова М. Д., 1966].
ЭТИОЛОГИЯ.
Причины возникновения асептического некроза эпифиза головки бедренной кости у детей остаются невыясненными, но продолжают обсуждаться инфекционная, травматическая, обменно-гормональная и наследственная теории, однако ни одно не имеет убедительных доказательств.
ПАТОГЕНЕЗ.
Поскольку заболевание относят к аваскулярной природе, особый интерес представляют ранние изменения в капсуле сустава и ее сосудах. А. Л. Капитанаки (1964) в капсуле тазобедренного сустава при остеохондропатии обнаружил скопление плазматических клеток, P. Mass (1957) выявил периваскулярную инфильтрацию лимфоцитами и плазматическими клетками, а Г. Г. Спиридонов (1959) в сосудах фиброзного слоя капсулы и прилегающей клетчатки обнаружил утолщение стенки сосуда с сужением его просвета. Такие изменения в капсуле напоминают аллергическое воспаление и, очевидно, относятся к начальным признакам остеохондропатии.
Выявляемое радиоизотопным исследованием нарушение кровообращения во всей пораженной конечности и расстройства микроциркуляции в виде застойных явлений в капиллярах ногтевого лимба пальцев стопы, их расширение и извилистость, замедление кровотока, застойный синюшный фон могут при болезни Легга—Кальве—Пертеса носить вторичный характер [В. М. Гартаницкая, 1973; Семенов В. А., Абальмасова Е. А., Крюкова Н. Н., 1972].
При микроскопическом исследовании бедренной кости в начальной стадии остеонекроза R. Mattner (1968) выявил некроз ядер остеоцитов, некроз костного мозга в субхондральных зонах, участки детрита в эпифизарном хряще. В. А. Штурм (1935) провел подробное макро- и микроскопическое исследование тазобедренного сустава мальчика 11 лет с III—IV стадией болезни Пертеса. Макроскопически выявлено, что при надавливании хрящ головки сдавливается и сплющивает размягченную под ним кость. Аналогичное размягчение кости выявляется в параэпифизарной зоне шейки бедра, где эпифиз, как колпачок, надет на шейку. Укорочение и расширение шейки бедра, грибовидная головка, возможно, образуются в результате этого оседания эпифиза. Костные балки эпифиза некротизированы и размягчены, напоминают губку. Некроз костных балок с жировым костным мозгом, бедным клеточными элементами, выявляется в эпифизе, шейке бедра и в меньшей степени в крыше суставной впадины и большом вертеле. В. А. Штурм на основании распространенности процесса рассматривал болезнь Пертеса как «остеохондропатию тазобедренного сустава», а не только эпифиза головки бедренной кости. Патологический процесс при этом носит характер глубокой дистрофии с некрозом губчатой кости, отчасти и хряща, особенно в зоне эпифизарного окостенения, с некрозом костного мозга [Штурм В. А., 1935; Шаиро Э. И., 1970; Ponseti J., 1956].
КЛИНИЧЕСКАЯ КАРТИНА.
Остеохондропатия головки бедренной кости возникает у детей в возрасте 5—10 лет, но возможны случаи заболевания в более раннем и более позднем возрасте. Как правило, поражается один, чаще правый, сустав, но при этом нередко меньшая степень остеохондропатических изменений выявляется и в другом суставе, которые могут подвергаться обратному развитию, не проходя всех стадий. Типичный двусторонний процесс встречается в 7—10% случаен, но, как правило, он развивается не одновременно [Капитанами A. Л., 1964]. Мальчики заболевают в 4—5 раз чаще девочек.
Клиника болезни Пертеса описана многими авторами, но до сих пор поздняя диагностика встречается нередко. Основной причиной поздней диагностики заболевания является слабая выраженность симптомов, продолжительные периоды безболезненного течения после появления и исчезновения первых болей.
Самыми ранними и частыми признаками болезни Пертеса являются боль и хромота. Однако в определенном проценте случаев боль отсутствует. Локализация болей непостоянная: у 65,9% больных она возникает в области тазобедренного сустава, у 12,4% больных — в коленном суставе, у 10,6% —во всей нижней конечности [Капитанаки А. Л., 1964]. Иногда дети жалуются на чувство стягивания в области большого вертела, где определяется выраженный, плотный, ограниченный отек.
Хромота в начале заболевания может быть результатом боли и контрактуры сустава, а позже следствием снижения высоты эпифиза, легкого подвывиха бедра и слабости ягодичных мышц. Наиболее часто при болезни Пертеса наблюдается ограничение внутренней ротации бедра — у 87,7—91,2% детей, несколько реже — ограничение наружной ротации сгибания — у 35,9%, приведения — у 30,9%. У 55% детей формируется сгибательная и наружно-ротационная контрактура [Капитанаки А. Л., 1964; Лимин А. Л., Хвисюк Н. И., 1970].
Атрофия мышц относится к ранним и постоянным симптомам; она более всего заметна в области ягодичных мышц и мышц бедра. В ряде случаев на фоне лимфостаза, утолщения кожи и подкожной клетчатки она может быть малозаметной. Симптом Александрова, как правило, бывает положительным. Могут иметь место выраженные вегетативно-сосудистые расстройства, которые более заметны при одностороннем процессе. К ним относятся бледность и похолодание стопы, снижение температуры конечности на 0,5—2°С, меньшая выраженность капиллярного пульса в области пальцев стопы, морщинистая кожа подошвы (кожа прачки), замедление биологической и гидрофильной проб, асимметрия реакции потоотделения по Минору, нарушения кровообращения во всей конечности в сравнении со здоровой, выявляемое при радиоизотопном исследовании [Гортаницкая В. М., 1973; Семенов В. А., Абальмасова Е. А., Крюкова Н. Н., 1974].
Острое начало болезни Пертеса встречается в 0,4—6% случаев, с подъемом температуры и воспалительным сдвигом в крови [Королев В. А., 1964; Фурдюк В. В., 1976; Mass P., 1962]. Однако и у детей с обычным течением нередко наблюдается субфибрильная температура, повышение СОЭ до 23—34 мм/ч, лейкоцитов до 109/л, лимфоцитов до 45—54% [Макушин В. Д., 1963; Абальмасова Е. А., Крюкова Н. Н., 1979].
РЕНТГЕНОЛОГИЧЕСКИЕ ПРИЗНАКИ.
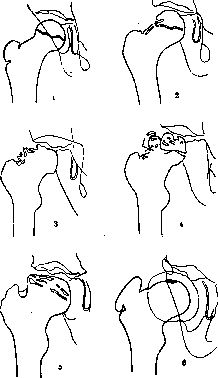
В течении остеохондропатии головки бедренной кости у детей различают пять последовательно развивающихся стадий, каждой из которых свойственны свои патоморфологические и рентгенологические особенности. I, начальная, стадия характеризуется некрозом губчатой кости эпифиза и костного мозга, II стадия — импрессионным переломом, III стадия — фрагментацией эпифиза, IV стадия — репарацией, V стадия — окончательным восстановлением кости.
Наибольшие трудности в рентгенологической диагностике испытывают именно при начальной (I) стадии заболевания. Поэтому для диагностики данной стадии различают три группы признаков: изменения в мягких тканях (капсуле и мышцах), проекционные изменения в костях таза и тазобедренного сустава, прямые признаки заболевания.
Проекционные признаки можно выявить лишь при условии правильной симметричной укладки больного и рентгенографии костей таза и обоих суставов. К этим признакам относят разную проекцию крыла подвздошной кости, запирательного отверстия справа и слева [Петухова Л. И., Волкова В. В.], расширение фигуры слезы [Halkier, 1956].
В качестве ранних косвенных признаков болезни Пертеса предложены рентгенометрические: смещение крестца в здоровую сторону; изменение формы линии Шентона из дугообразной в квадратную; увеличение эпифизарно-диафизарного угла Альсберга; увеличение угла, образованного пересечением оси бедра с плоскостью входа в суставную впадину; уменьшение угла, образованного пересечением линии Хильгенрейнера с продолжением линии эпифизарного хряща; смещение вершины и увеличение угла, образованного пересечением сагиттальной оси таза с продолжением плоскости входа в суставную впадину [Абальмасова Е. А., Крюкова И. Н., 1979].
В конце I стадии в параэпифизарной зоне шейки бедренной кости могут выявляться очаги деструкции, в области которых позже формируются кистевидные просветления; шейка укорачивается, становится шире. Первая стадия продолжается до 6 мес [Рейнберг С. А., 1964].
Во II стадии — импрессионного перелома, при которой некротические костные балки, теряя прочность под влиянием статической и динамической нагрузки, надламываются и импрессируются. Рентгенологически в этой стадии тень эпифиза уплотняется; структура его утрачивается, а высота снижается, суставная щель соответственно расширяется. Начиная с этой стации диагностика заболевания не представляет затруднений. II стадия продолжается от 3 до 6—8 мес.
В III стадии фрагментации эпифиза, при которой происходит реваскуляризация эпифиза со стороны надкостницы шейки бедренной кости, хряща головки, губчатой кости шейки. В глубь некротической кости эпифиза врастает соединительная ткань, а вместе с ней и сосуды. Они разделяют головку на отдельные фрагменты, а в шейке образуются кисты различных размеров. Эта стадия продолжается от 1 до 1,5 лет. Одновременно за рассасыванием старой кости следует процесс образования новой кости, который идет активнее с внутренней стороны, а в центре головки могут длительно сохраняться плотные секвестроподобные тени.
В IV стадии — репарации; при ней секвестроподобные тени исчезают, эпифиз полностью замещается новообразованной костью с участками просветления в центре.
В V стадии — конечной, соответствующей восстановлению формы головки и структуры, характерной для зрелой кости. Восстановление головки может быть двояким; при благоприятных исходах высота эпифиза головки приближается к его высоте в нормальном суставе. Однако при самых идеальных исходах высота головки восстанавливается не боле чем па 85%. При менее благоприятных исходах головка имеет грибовидную форму; она на 30—70% не перекрывается впадиной, у 75% больных впадина уплощается и вытягивается кверху [Редулеску А., 1967]. Шейка бедренной кости укорачивается и расширяется. В этих случаях может формироваться подвывих бедра.
У детей с подвывихом создаются условия к раннему развитию деформирующего артроза, который В. М. Ермолаев и П. Д. Мицкевич наблюдали уже у больных в возрасте 15—20 лет. М. Д. Крылова (1971) описала локализованную форму остеохондропатии в верхне-наружном квадранте головки, а А. Л. Лимин, Н. И. Хвисюк (1970) в 19% наблюдали субкапитальную форму — с более благоприятным течением.
ЛЕЧЕНИЕ.
Комплексное консервативное лечение болезни Пертеса предусматривает прежде всего полную разгрузку конечности, улучшение и восстановление кровообращения в области тазобедренного сустава и в пораженной конечности, стимулирование процессов рассасывания некротической костной ткани и следующих за ним процессов новообразования, сохранение функции сустава, поддержание физиологического тонуса мышц конечности и общего мышечного тонуса.
Полную разгрузку конечности следует назначать немедленно, как только поставлен диагноз. Разгрузка конечности предупреждает дальнейшее снижение высоты эпифиза, последующее восстановление которого происходит только в пределах исходной высоты. В процессе лечения никакими средствами невозможно увеличить высоту уплощенного эпифиза.
С целью разгрузки используют вытяжение манжетой за голеностопный сустав или шинно-гильзовый тутор, обычно туго фиксированный на бедре и голени. При атрофии мышц и распространенных вегетативно-сосудистых нарушениях во всей конечности (прежде всего выраженных застойных явлениях в венозном русле) такие виды вытяжения следует считать нерациональными и даже вредными.
Широкое применение нашла гипсовая кроватка и глухая гипсовая повязка, лечение в которых каждые 3—4 мес чередуют с функциональным восстановительным лечением или скелетным вытяжением [Somervill Е., 19711. М. Harrison и М. Меnon (1966), изучив результаты лечения болезни Пертеса всеми существующими методами, нашли, что наилучшим оказался метод фиксации бедер туторами с внутренней ротацией и умеренным отведением. При этом методе головка бедренной кости центрируется в суставной впадине, а фиксированное отведение бедер уменьшает давление на пораженную головку; при этом методе также сохраняется подвижность в тазобедренных и голеностопных суставах.
Общую гимнастику для верхних и нижних конечностей (исключая пораженную конечность), мышц спины и брюшной стенки начинают проводить с I стадии и продолжают постоянно. В это время ребенка заставляют производить активные сокращения ягодичных и четырехглавой мышц на больной стороне, активные движения в голеностопном суставе. В III стадии детям разрешают присаживаться, им проводят легкие пассивные движения в тазобедренном и коленном суставах. С IV стадии подключают активные упражнения для пораженного тазобедренного сустава. Указанный ортопедический режим следует сохранять до стадии восстановления головки бедренной кости. С восстановлением структуры головки и шейки, свойственной зрелой кости, в положении лежа используют упор на пружинных приспособлениях (ходьба лежа), вращение на стационарном велосипеде, легкую опору на конечность во время ходьбы па костылях.
Полную нагрузку на конечность разрешают лишь после того, как на двух последних рентгенограммах, сделанных с интервалом в 2—3 мес после указанного выше подготовительного лечения, структура головки и шейки бедренной кости остается неизменной.
Нагрузку на конечность без костылей в первый год после окончания лечения увеличивают постепенно, полностью исключая прыжки, переходы на большие расстояния, подъем тяжести, приседания. В это время рационально использовать прогулки па велосипеде, плавание. В дальнейшем перенесшим болезнь Пертеса лицам необходимо избегать чрезмерных нагрузок на сустав, систематически проводить утреннюю гимнастику, преимущественно лежа, полностью исключая упражнения приседания; для них полезно пребывание на море в летнее время и плавание в бассейне — в зимнее. Эти меры необходимы для предупреждения развития раннего деформирующего артроза в тазобедренном суставе. Массаж пораженной конечности проводят во всех стадиях заболевания с перерывами на 3—4 нед; он направлен прежде всего на устранение застойных явлений в лимфатической и венозной системах конечности и улучшение активного кровообращения.
Медикаментозные средства в комплексном лечении болезни Пертеса занимают важное место, обеспечивая прежде всего нормализацию кровообращения в пораженной конечности, стимулирование процессов рассасывания и регенерации. Учитывая преобладание спастического типа кровообращения, в качестве сосудорасширяющих средств используют никотиновую и аскорбиновую кислоту, но-шпу, никошпан, депо-падутин и др. Наибольший сосудорасширяющий эффект у детей получен от никотиновой и аскорбиновой кислоты, что подтверждено капилляроскопией. Поэтому со II до V стадии следует применять указанные средства, чередуя их и делая перерывы на 1—1,5 мес. На протяжении всего периода лечения детям дают комплексы витаминов. Л. А. Смирнова и Е. А. Вишневецкая (1976) с целью стимулирования остеогенеза применяли повторные курсы инъекции витамина В12, который, являясь неврогенным стимулятором, способствует нормализации и вегетативно-сосудистых функций; применяют парафин, озокерит (t 35—38°С), грязевые аппликации, горячие ванны и укутывания. Однако при венозном застое, что характерно для I стадии, эти средства лишь увеличивают застойные явления, что подтверждено данными капилляроскопии [Абальмасова Е. А., Крюкова Н. Н., 1979].
Указанные тепловые процедуры наиболее рационально назначать в стадии фрагментации, репарации и окончательного восстановления.
В стадии импрессионного перелома, особенно в стадии фрагментации, рационально использовать алоэ, ФиБС, стекловидное тело, электрофорез с препаратами, содержащими йод, что ускоряет рассасывание некротической кости [Волков В, В., Ковальская О. А., Шифрис А. Ш., 1965], диатермию, УВЧ, а в стадиях восстановления — электрофорез с хлоридом кальция и препаратами, содержащими фосфор. Как указывают В. И. Рокитянский (1962), А. Н. Рыжих (1966), А. С. Мартене (1967), электрофорез с йодидом кальция ускоряет восстановление костной ткани, а ультразвук активирует рассасывание некротической костной ткани.
Все указанные лечебные средства у детей с болезнью Пертеса применяют на фоне общеукрепляющего лечения (поливитамин, рыбий жир, глюконат кальция, апилак, гелио- и аэротерапия, питание богатое белками и витаминами).
Результаты консервативного лечения.
Общая продолжительность консервативного лечения, но данным различных авторов, колеблется от 2—3 до 4—6 лет [Рейнберг С. А., 1925; Крылова М. Д., 1971; Приезжева В. Н., 1971; Somervill E., 1971]. Продолжительность и результаты лечения находятся в прямой зависимости от возраста детей к началу заболевания и от стадии болезни к началу лечения. Чем меньше возраст ребенка и чем раньше начато лечение, тем быстрее и полноценнее завершается процесс восстановления головки бедра.
В оценке результатов лечения болезни Пертеса используют преимущественно трехбалльную систему, которая является довольно субъективной. Так, по данным Н. Waldenstrom (1922), отличные функциональные исходы получены у 62% детей, хорошие — у 25% детей, удовлетворительные — у 13%. Рентгенологически у этих же больных хорошие исходы определены только у 30% детей, удовлетворительные — у 54%, плохие — у 16% детей. Как указывает автор, остеохондропатический процесс лишь в редких случаях не оставляет последствий и поэтому нельзя рассчитывать на хорошие исходы самоизлечения. И. М. Шаматов и В. В. Синев (1966) подтверждают это: из наблюдаемых ими 28 детей с болезнью Пертеса, из которых 22 ребенка лечения не получали, в отдаленные сроки (до 9—30 лет) у 14 была выраженная хромота и симптом Тренделенбурга, у 22 — укорочение бедра, диффузная атрофия мышц (на 2—4 см), ограничение отведения и особенно внутренней ротации бедра. Ограничение сгибания и разгибания в тазобедренном суставе имелось у всех больных. На рентгенограмме у всех больных головка была грибовидной формы, а у 13 края ее выступали за край впадины. Эти данные убедительно подтверждают необходимость систематического лечения болезни Пертеса у детей. А. Л. Капитанаки (1963) из 95 детей, у которых лечение начато своевременно, хорошие результаты получил у 80, а из 40 детей, которым лечение начато поздно, такие результаты наблюдались только у 16.
К хирургическому лечению остеохондропатии головки бедренной кости прибегают сравнительно редко. Оно направлено на ускорение реваскуляризации эпифиза головки и сокращение сроков лечения. Однако А. Л. Капитанаки (1963) считает хирургическое лечение показанным в случаях замедленного рассасывания некротических костных балок эпифиза, что может быть выявлено не ранее чем через 1—1,5 года от начала болезни, а Э. И. Шаиро (1970) рекомендует его во всех случаях в стадии импрессионного перелома.
Предложены различные хирургические методы лечения болезни Пертеса: чрезвертельная остеотомия бедра [Козловский А. А., 1924], транстрохантерно-цервикальный остеосинтез [Fergusson A., 1955; Howorth M., 1966], туннелизация шейки и эпифиза бедра спицей Киршнера при затянувшейся III стадии. В качестве постоянного раздражителя для реваскуляризации и костеобразования используют алло- и ксенотрансплантаты, свободный аутотрансплантат, аутотрансплантат на питающей ножке [Шаиро Э. И., 1970]. Небольшое число наблюдений каждого из перечисленных методов у отдельных авторов не позволяет дать им объективную оценку. А. Л. Капитанаки отметил ускорение реваскуляризации эпифиза головки бедра у 8 из 9 больных после туннелизации и у одного из трех — после межвертельной остеотомии бедра. Э. И. Шапиро (1970) при введении в шейку и эпифиз бедра аутотрансплантанта на питающей сосудистой ножке отметил сокращение сроков восстановления эпифиза головки бедра. В экспериментальных исследованиях получены морфологические доказательства проникновения сосудов через питающую надкостнично-мышечную ножку трансплантата в шейку и эпифиз бедра.
После чрезвертельной остеотомии развивается остеопороз в проксимальном отделе бедра, который сохраняется длительное время, но последующего ускорения восстановительных процессов и улучшения исходов не установлено. Гомотрансплантат, введенный в шейку бедра, сохраняется неизмененным до 4—6 лет, а в ряде случаев вокруг него образуется склеротический вал, возможно, как проявление тканевой несовместимости. Такие трансплантаты, безусловно, не являются стимуляторами процессов реваскуляризации и костеобразования.
В случаях длительного сохранения стадии импрессионного перелома в эпифизе или при наличии в нем секвестроподобных участков мы применили просверливание канала от основания большого вертела через шейку в эпифиз троакаром диаметром 0,5—0,7 см и дополнительное просверливание 8—10 каналов спицами. Через такие каналы врастает богатая сосудами грануляционная ткань, что улучшает питание кости.
(по материалам открытых интернет-источников)
.gif)
.gif)