мантры для активации шишковидной железы
Использование крайне-высоко частотных широкодиапазонных электромагнитных полей в практической медицине
Д.м.н. Корчажкина Н.Б., к.м.н. Руев В.В., к.т.н. Рябов Б.А.
В настоящее время терапия с использованием КВЧ-диапазона нашла широкое распространение в практической медицине. Этому способствовали интенсивные теоретические, экспериментальные и клинические исследования, проводимые в ряде медицинских учреждениях бывшего СССР в середине 60-х годов. Уже в конце 70-х, начале 80-х годов началось внедрение в практическом здравоохранении генераторов электромагнитного излучения миллиметрового диапазона.
Большой вклад в разработку научной теории по применению электромагнитных волн мм-диапазона, а также в подготовку лечебных методик внесли Н. Девятков, В. Адаменко, М. Голант, В. Недзвецкий, Э. Николаева, О. Бецкий, С. Ситько, А. Веткин, В. Портнов и другие специалисты. Метод доказал свою хорошую эффективность при лечении широкого круга заболеваний, в том числе: органов пищеварения, органов дыхания, сердечно-сосудистой системы, нервной системы, опорно-двигательного аппарата и др.
В шкале электромагнитного излучения КВЧ-диапазон располагается между инфракрасным излучением (светотерапией) и СМВ-терапией. КВЧ-диапазон включает в себя частоты от 30 до 300 ГГц или длинны волн от 10 до 1 мм.
Электромагнитные волны мм-диапазона сильно поглощаются в воде и в водных растворах, так в 1 мм водной среды мощность, при длине волны 8 мм, ослабляется в 100 раз, а при длине волны 2 мм – в 10000 раз. При этом глубина проникновения электромагнитных волн КВЧ-диапазона в ткани пациента во время процедуры колеблется от 0,2 до 0,5 мм.
Существует несколько основных гипотез, предложенных для объяснения лечебного эффекта КВЧ-воздействия.
Согласно гипотезе Н. Девяткого и М. Голанта первичное действие КВЧ излучения связано с общими для различных биологических объектов структурами (полипептиды, аминокислоты, белки-ферменты, клеточные мембраны и пр.), имеющими дипольными электрические моменты с собственными частотами, совпадающими с диапазоном миллиметровых волн. Воздействие внешнего электромагнитного излучения КВЧ-диапазона инициирует акустоэлектрические волны в клеточных мембранах. В результате этого клетка начинает генерировать сигналы управления восстановительными и приспособительными процессами в организме животных и человека. В зависимости от частоты воздействия возникают те или иные биологические эффекты, направленные на устранение имеющихся нарушений.
Гипотеза О. Бецкого и И. Петрова говорит о молекуле воды как о первичной мишени электромагнитного излучения КВЧ-диапазона. При этом происходит своеобразная «ММ-накачка» воды верхних слоев кожи, что, в свою очередь, ведет к увеличению количества молекул воды с повышенной химической активностью. Их соударения со слабогидратированной поверхностью могут служить каналом передачи возбуждения в более глубокие слои кожного покрова, где находятся гидрационно-чувствительные входные элементы регуляторных систем. Изменение степени гидратации белков клеточной мембраны приводит их к конформационным изменениям, что отражается на ионном транспорте и активности АТФ-синтетазы энергообразующих мембран. Синтез АТФ и накопление ее обуславливает физиологические эффекты стимуляции. Конечный эффект воздействия на организм формируется с участием нейрогуморальной системы и зависит от того, какими органами, областями кожи или точками воспринято излучение.
Гипотеза С. Ситько предполагает наличие для каждого биологического объекта, в том числе человека, собственных «характеристических частот». Согласно этой гипотезе можно говорить о наличии «электромагнитного каркаса» любого биологического объекта. В результате патологического процесса нарушается не частота колебания клеточных структур (частота константа), а амплитуда колебательных движений. В результате воздействия внешнего электромагнитного излучения КВЧ-диапазона возникает эффект резонанса, который характеризуется своеобразным «откликом» организма. В результате проведенной терапии, с использованием КВЧ-диапазона, происходит выравнивание нарушенной амплитуды. Осуществляется это при помощи подбора индивидуальной терапевтической частоты. Распространение мм-волн в организме человека и животных происходит по «каналам», описанным в «ЧЖЕНЬ-ЦЗЮ» терапии.
Гипотеза, предложенная сотрудниками «МТЦ КОВЕРТ», говорит о том, что игла или мокса (полынная сигара) воздействуют на энергетические процессы в организме, подчиняющиеся законам энергообмена, одним из моментов которого является переход электронов на различные энергетические уровни с воздействием или поглощением энергии (трансформация одного вида энергии в другую, например, механической в электрическую). Экспериментально доказано, что наиболее древние способы воздействия на точки акупунктуры – игла и мокса воздействуют непосредственно электромагнитным излучением, в том числе миллиметрового диапазона: игла – антенна, улавливающая ЭМИ Солнца, мокса – сама излучает ЭМИ КВЧ диапазона. Замена традиционных инструментов Восточной пунктуры на аппаратный широкодиапазонный КВЧ генератор позволила оптимизировать величину сигнала воздействия, что обеспечило максимальный восстановительный и лечебный эффект. Широкодиапазонное электромагнитное излучение КВЧ-диапазона крайне низкой интенсивности приводит к продуцированию организмом биологически активных веществ – эндогенных лекарств в тех уникальных композициях и концентрациях, которые необходимы для оптимального выздоровления данного, а не некоего «усредненного» пациента, тем самым данное излучение оказывает нормализующее лимитирующее воздействие.
При анализе теоретических и практических работ, посвященных проблемам КВЧ диапазона, выделяются три типа наблюдаемых эффектов:
Одной из наиболее интересных особенностей взаимодействия электромагнитного излучения КВЧ-диапазона с биологическими объектами является выраженная резонансная зависимость получаемых откликов. В экспериментальных условиях просматривается наличие резонансного взаимодействия с растворами молекул гемоглобина, нуклеиновых кислот, клеточными мембранами и культурами клеток. Использование электромагнитного излучения КВЧ-диапазона с последующим воздействием ионизирующего излучения выявило наличие частот, обладающих гемопротекторным эффектом. Исследования, проведенные в клинических условиях, также продемонстрировали наличие у человека «резонансных» частот, позволяющих получать стойкий терапевтический эффект.
Ряд авторов утверждает что положительный эффект при терапии, с использованием КВЧ-диапазона, может быть получен с любой зоны облучения, тем не менее, в ряде экспериментов получено обратное. Так при изменении места приложения электромагнитного излучения КВЧ-диапазона меняются частоты, оказывающие терапевтический эффект. Исследование реакций организма на КВЧ-излучение установило, что афферентные сигналы, идущие с места поглощения КВЧ-излучения, несут определенную информацию лишь о месте нанесения раздражителя. Позже была выявлена необходимость индивидуальной зоны воздействия для повышения эффективности клинического применения волн КВЧ-диапазона.
Лечебные методики, с использованием КВЧ-диапазона, формируется из трех основных групп:
— с индивидуальным подбором частоты электромагнитного излучения мм-диапазона и индивидуальным подборам точек акупунктуры (Миллиметровая терапия);
— с индивидуальным подборам зон воздействия (КВЧ пунктура);
— без индивидуальной частоты электромагнитного излучения и зоны воздействия (КВЧ-терапия).
В основе Миллиметровой терапии с индивидуальным подбором частоты электромагнитного излучения КВЧ-диапазона лежит понятие о наличии собственных «характеристических частот» организма. На первой процедуре лечения выбирается строго определенная точка акупунктуры, чаще всего «ЛО» пункт. Затем на нее осуществляется воздействие электромагнитным излучением КВЧ-диапазона чаще всего с 52,00 до 78,00 ГГц, при этом используется режим сканирования с шагом 200 или 50 МГц и временем сканирования 15-20 секунд. В результате воздействия в организме пациента возникает своеобразный комплекс ответных реакций или «сенсорные реакции», которые делятся на местные, системные, общие и проявляются в виде мурашек, покалывания, онемения, тепла, изменении эмоционального фона, сонливости и др.. После того как подобрали индивидуальную терапевтическую частоту, составляется рецептура из точек акупунктуры, которые обрабатываются полученной терапевтической частотой, с соблюдением всех правил «ЧЖЕНЬ-ЦЗЮ» терапии. По мере проведения курса лечения и улучшении состояния больного выраженность сенсорных реакций в организме пациента уменьшается и затем полностью исчезает. За один курс лечения воздействие осуществляется, как правило, на 3-4 точки акупунктуры. Продолжительность одного сеанса длится в среднем 15-25 минут. На один курс лечения назначается 5-15 процедур.
Сенсорный отклик сопровождается изменением различных параметров функционирования организма пациента, что может быть выявлено с помощью лабораторных методов исследования, ЭКГ, ЭЭГ, тепловизора, экспресс диагностики «АМСАТ» и др.
Для работы по методу Миллиметровой терапии используется следующая аппаратура:
Аппараты «АМТ–04–02» и «АМТ–04РС», работающие в режимах «свипирования», «сканирования» и «одночастотном». Диапазон частот данных аппаратов колеблется от 54,00 до 75,00 ГГц. Время сканирования частот от 1 до 60 секунд, с шагом переключения частот 200, 50 и 10 МГц. Данная аппаратура имеет максимальную мощность порядка 0,3 мВт. Аппараты имеют два излучателя с площадью апертуры 6,5 кв. мм и 2,25 кв. см., которые предназначены для работы по точкам акупунктуры и по зонам.
В последнее время неоднократно публиковался теоретический и клинический материал в котором говорится о том, что ведущее значение в повышении эффективности лечения принадлежит зоне воздействия, а не частоте электромагнитного излучения КВЧ диапазона (КВЧ-пунктура). КВЧ-диапазон электромагнитного излучения определяет лишь особенности поглощения мм волн водосодержащими структурами кожи, их отражение и поглощение, а следовательно и интенсивность раздражения облучаемой зоны. Конечный неспецифический эффект КВЧ воздействия реализуется при участии различных регулирующих систем пациента и существенно не отличается от эффектов, возникающих при воздействии других факторов электромагнитной и неэлектромагнитной природы. Точки акупунктуры обладают высокой чувствительностью к электромагнитному излучению КВЧ-диапазона, это связано с их высокой гидратированностью. Рецептура точек акупунктуры составляется с соблюдением всех законов иглорефлексотерапии. При КВЧ-пунктуре обычно используется фиксированная частота электромагнитного излучения КВЧ-диапазона, а также генератор «шума» или комбинированное излучение. Для работы по данной методике используются аппараты серии «АРЦАХ», «ПОРОГ», «МИДИС-КВЧ-710», «ЭЛЕКТРОНИКА КВЧ» и др.
Аппараты серии «АРЦАХ» работают в «когерентном» и «шумовом» режимах в диапазоне частот 42-95 ГГц и 95-160 ГГц, максимальная выходная мощность 5 мВт.
КВЧ терапия без индивидуализации частоты электромагнитного излучения мм-диапазона и зоны воздействия – это чисто физиотерапевтический метод лечения который не требует знаний иглорефлексотерапии. При создании этой методики КВЧ-терапии авторами утверждалась необходимость индивидуального подбора частоты и резонансных характер взаимодействия электромагнитного излучения КВЧ-диапазона с биообъектами. Однако объем используемых частот не позволяет осуществить данный подбор. В настоящее время широко используют аппараты:
«ЯВЬ 1-5,6», с частотой генерации 53,53 ГГц, выходная мощность не более 25 мвт;
«ЯВЬ 1 7,1», с частотой генерации 42, 19 ГГц, выходная мощность не более 25 мвт;
«ЯВЬ 1М», с частотой генерации 42 – 54 ГГц,
«КВЧ-НД», с частотой генерации 60,12 ГГц, 53,53 ГГц, 42,19 ГГц, выходная мощность не более 6-10 мВт.
Пятно засветки данных аппаратов не превышает 4 кв. см.. Количество сеансов на курс лечения от 10 до 20. Продолжительность одной процедуры 15-60 минут. Воздействие осуществляется на рефлексогенные зоны Захарьина-Геда, на точки акупунктуры, на аурикулярные точки, на область крупных суставов, на грудину, на затылочную кость, на решетчатый лабиринт, на эпигастрий, непосредственно на очаг заболевания.
Область крупных суставов характеризуется рыхлой соединительной тканью дермального слоя, большим количеством протеингликанов, протеинкиназ и ингибиторов, высокой гидрофильностью, а также рядом других особенностей метаболизма и микроциркуляции с обилием венозных структур. Зоны Захарьина-Геда характеризуются отеком, гипертермией, гиперестезией, гиперемией и другими проявлениями гиперфункционального состояния кожи в определенных местах, связанных с теми или другими органами. С точки зрения ЧЖЕНЬ-ЦЗЮ терапии зоны Захарьина-Геда полностью соответствуют понятию Сухожильно-мышечных каналов и их поражению по типу Полноты или Пустоты соответственно. Основу точек акупунктуры формирует рыхлая соединительная ткань с большим количеством нервных рецепторов, свободных нервных окончаний, развитой сосудистой системой, клеточными элементами, содержащими биологически активные вещества. Точка акупунктуры также обладает повышенной гидратированностью и чувствительностью к электромагнитному излучению КВЧ-диапазона.
Длина волны 4,9 мм (61,12 ГГц) выбрана киевскими исследователями Г.Гасановым, О. Писанко, В.Пясецким на основании соображений, связанных с максимумом поглощения данной частоты молекулярным кислородом в атмосфере. Длина волны 7,1 мм (42,19 ГГц) выбрана разработчиком аппаратуры Ю.Дедиком на основании результатов, полученных Л.Севастьяновой, М.Голантом, Т.Ребровой при лечении злокачественных образований у животных. Длина волны 5,6 мм (53,53 ГГц) выбрана экспериментально В.Недзвецким и И.Черкасовым на основании положительного результата лечения язвенной болезни желудка и 12-ти перстной кишки. В одних случаях используется одна и та же частота на протяжении всего курса лечения, в других случаях вышеуказанные частоты могут меняться или комбинироваться. Выбор частоты осуществляется или с учетом диагноза, или после оценки реакции крови на КВЧ воздействие.
В настоящее время постоянно расширяется круг нозологических форм и синдромов, при которых достигается положительных эффект КВЧ воздействию. Поэтому до настоящего времени четко очерченных показаний для применения этого нового метода лечения. В данный момент аппаратура для Миллиметровой терапии (с частотой генерации от 52,00 до 78,00 ГГц) проходит клиническую апробацию в Московском городском онкологическом диспансере, с целью лечения онкологических больных в предоперационном и послеоперационном периодах.
В зависимости от применяемых методик лечения электромагнитными волнами КВЧ-диапазона имеются различные противопоказания:
Побочные действия при Миллиметровой терапии и при КВЧ-пунктуре не описаны. При КВЧ терапии у больных с гипертонической болезнью иногда наблюдается ухудшение общего самочувствия, преходящие вегетативные симптомы, колебания АД и гипертонические кризы, а в случаях сочетания с медикаментозной терапией описаны случаи бронхоспазма.
В результате воздействия электромагнитных волн КВЧ-диапазона на организм пациента происходит повышение количества Т-лимфоцитов и их активных фракций, увеличивается содержание моноцитов периферической крови, увеличивается содержание иммунного интерферона, нормализуются стрессовые и адаптогенные гормоны и другие показатели крови. Достигается высокий уровень снятия болевого синдрома. Отмечается лучшая переносимость химио- и рентгенотерапии, в следствии более быстрого снятия миелодепрессии, лейкопении, тромбоцитопении и анемии.
Для контроля проводимой терапии электромагнитными волнами КВЧ-диапазона используются традиционные методы исследования, в том числе эффективность проводимой терапии можно проследить при помощи экспресс-диагностики «АМСАТ» (Автоматизированная медицинская система анализа терапии). Кроме того для точной дозировки проводимой КВЧ терапии можно использовать метод оценки индекса активности сукцинатдегидрогиназы (ИА СДГ).
С этой целью по специальной окраске, предложенной разработчиками МНИЦ «ВИДГУК», подсчитывается количество темно-синих гранул формазана в 50 лимфоцитах периферической крови с последующим вычислением средней величины. Подсчет осуществляется до начала лечения, после первой, пятой и десятой процедуры. При правильном лечении ИА СДГ увеличивается в среднем в 1,5-2,5 раза. Для каждого региона характерен свой ИА СДГ.
Типы изменений индекса активности сукцинатдегидрогеназы при воздействии электромагнитными волнами мм-диапазона представлены на рисунке 1.
Список литературы.
«Слабые и сверхслабые поля излучения в медицине и биологии» – II Международный Конгресс, сборник докладов, Санкт-Петербург, 2000 год.
«Информационно-волновая медицина и биология» – I Международный Конгресс, сборник докладов, Пафос (Кипр), 1998 год.
Мантры для активации шишковидной железы
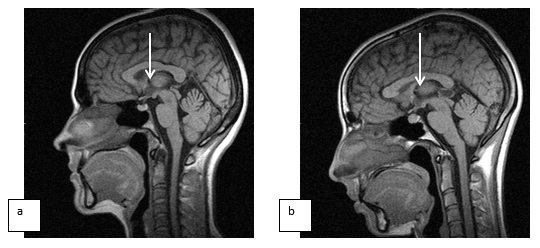
Введение. В последние годы возрастает интерес к шишковидной железе, что объясняется не только её способностью к выработке мелатонина, считающегося одним из факторов регуляции биоритмов, но и нейроэндокринным посредничеством с гормональной, нейромедиаторной активностью [1]. Из-за своего глубинного расположения сама шишковидная железа до появления томографических методов была труднодоступна для исследования, на рентгенограммах обычно была видна лишь в случаях её обызвествления. Даже с появлением компьютерной томографии, при отсутствии в ней объемных образований, исследователи продолжали ссылаться на данные, полученные в результате аутопсии, указывая при этом как размеры, так и вес железы, полученные в результате вскрытий. Заметный прорыв в этом вопросе произошел с появлением магнитно-резонансной томографии, когда при исследовании гипофиза тонкими срезами в сагиттальных сечениях шишковидная железа всегда попадала в плоскость сечения, и появилась возможность её детализации, четкого прижизненного описания. С этого момента внимание стали привлекать кисты в шишковидной железе, генез которых до сих пор остается во многом не ясным, как и подходы к кратности обследования и вообще лечения таких больных.
Цель исследования – проследить проспективно возможные изменения размеров и структуры шишковидной железы у женщин детородного периода в норме и при наличии гиперпролактинемии.
Результаты исследования и обсуждение
Киста шишковидной железы 9х13 мм с частичной компрессией водопровода, микроаденома до 3 мм передней доли
Полученные размеры отличаются от размеров шишковидной железы, приводимых в анатомических руководствах, что объясняется тем фактом, что там описываются усредненные значения по всем возрастным группам, причем, как правило, на патоморфологическом материале, а не взятом от живых людей. Кроме того, известен тот факт, что шишковидная железа и её пик активности приходится на детский возраст, и к 6 годам она редуцируется, уменьшается в размерах. Сохранение её или увеличение в наших случаях у больных с гиперпролактинемиями соотносилось с отклонением в структуре гипофиза и, как следствие, затянувшимся пубертатом, дисменореями, бесплодием. В репродуктивном периоде её увеличение, возможно, также обуславливалось приёмом контрацептивных средств, поскольку в данном варианте нарастало количество гиперпролактинемий.
Обращало внимание сочетание гиперпролактинемии, микроаденом и кист шишковидной железы. Так, в настоящем исследовании, в группе практически здоровых лиц мелкие кисты (от 6 до 7 мм) отмечались в единичных случаях (до 4%), а у больных с гиперпролактинемиями в случайной выборке (n=45) кисты отмечались в 34% случаев. Еще больший процент отклонения в размерах шишковидной железы от нормы был при аденомах и при приёме контрацептивов, где максимальное значение достигало 50%. При этом размеры шишковидной железы уже составляли: передне-задний до 11 мм; высота – 6-7 мм, что значительно превышало размеры шишковидной железы в контрольной группе (p 30).
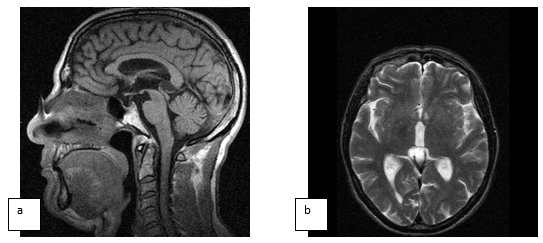
Увеличение в размерах шишковидной железы, вероятно, обуславливается ингибирующим действием на активацию передней доли гипофиза. Взаимосвязь между шишковидной железой и гипофизом намного сложнее, чем это принято считать. Описаны механизмы не только угнетающего воздействия на гипофиз с её стороны, но и стимулирующего характера. Такой афферентный тип регуляции на межорганном уровне, безусловно, должен существовать, иначе сложно объяснить увеличение шишковидной железы в случаях выраженной гипотрофии гипофиза, при синдромах пустого турецкого седла, как представлено ниже (рис. 2).
Рис. 2. Сагиттальное (a) Т1- и аксиальное Т2-сечение (b) с толщиной срезов 3 мм без применения контрастирования больной С., 40 лет, с гиперпролактинемией. Формирование пустого турецкого седла. Киста шишковидной железы с незначительным сдавлением водопровода и ликвородинамическими нарушениями
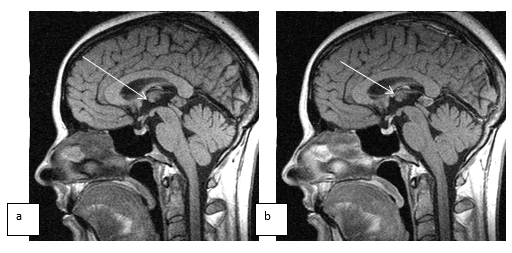
Вместе с тем «ингибирующий» характер увеличения шишковидной железы отмечался у больных с микроаденомами гипофиза, локализующимися как в передней, так и в промежуточной части гипофиза. Чаще всего в форме ретенционной кисты шишковидная железа была в тех случаях, когда в анамнезе были детские инфекции, риносинуситы, а также травмы и инфекции в родах. При контрастировании парамагнетиками края таких кист и иногда сами кисты хорошо накапливают контраст (рис. 3).
Рис. 3. Больная С., 33 лет, до и после контрастирования омнисканом, томограммы, выполненные в Т1 сагиттальных сечениях. Шишковидная железа неоднородная, 12 х 10 мм, капсула накапливает контраст при введении парамагнетика. Участки уплотнения и капсула отмечены стрелкой
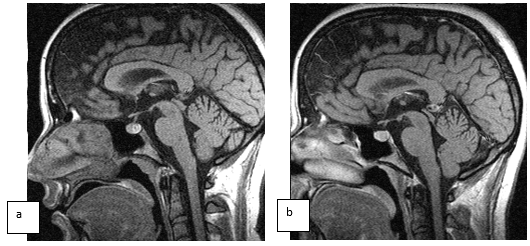
Характерной особенностью ретенционных кист шишковидной железы было отсутствие какой-либо динамики в выборке за период наблюдения (рис. 4).
В данном случае за период наблюдения отмечен прирост в размерах микроаденомы гипофиза по всем направлениям в пределах 2 мм, в то время как объем кисты шишковидной железы остался без существенной динамики.
Мелатонин также выступает в качестве нейропротектора и антиоксиданта. В ряде зарубежных исследований получены результаты корреляции среди случаев снижения секреции мелатонина у пациентов старше 45 лет и увеличения случаев нейродегенеративных заболеваний, таких как болезнь Альцгеймера и болезнь Паркинсона, депрессии, инсульта и рака. Шишковидная железа имеет склонность к кальцификации, многими авторами высказано предположение, что дефицит мелатонина вызывает обызвествление шишковидной железы. Имеются данные о том, что мелатонин, секретируемый шишковидной железой, взаимодействует с гипофизом, модулируя высвобождение его гормонов. Некоторые ранние зарубежные исследования показали, что стимуляция активности шишковидной железы in situ ингибирует пролиферацию гипофизарных клеток. С другой стороны, также было показано, что гипофизэктомия приводит к атрофическим изменениям в шишковидной железе, что указывает на регуляторную отрицательную обратную связь гипофиза. Большинство исследователей пришли к выводу о том, что повышенный уровень мелатонина вызывает нарушение репродуктивной функции, вызывая гиперпролактинемию, снижая секрецию гормона роста и нарушая функцию надпочечников через гипоталамо-гипофизарную ось, а также опосредованно воздействует на гонады (яичники и яички). Нормальный уровень мелатонина в утренние часы варьируется от 8 до 20 пг/мл, в ночные – не должен превышать 150 пг/мл. Повышенные показатели говорят о психических расстройствах (депрессия, маниакальные состояния); пониженной выработке эстрогенов, снижении (отсутствии) либидо. Повышение уровня пролактина некоторыми авторами рассматривается как один из механизмом запуска артериальной гипертензии и ожирения [10; 11].
Препараты зарегистрированные в Украине
Шишковидная железа: физиологическая роль в организме, функциональная недостаточность в пожилом возрасте, возможные пути коррекции
Коркушко О.В., Шатило В.Б.
Первые упоминания о шишковидной железе (эпифизе) появились более 2300 лет назад, однако ее физиологическая роль оставалась неизвестной до открытия мелатонина в 1958 г. Шишковидная железа продуцирует около 80% циркулирующего в крови мелатонина, синтез которого осуществляется также сетчаткой и цилиарным телом глаза, энтерохромафинными клетками желудочно-кишечного тракта.
Предшественником мелатонина является аминокислота триптофан, которая захватывается клетками шишковидной железы, затем трансформируется в серотонин, из которого посредством ацетилирования и последующего О-метилирования образуется мелатонин. Образовавшийся мелатонин не накапливается в эпифизе, а сразу поступает в кровоток путем пассивной диффузии. В крови 70% гормона связано с альбуминами. Полупериод жизни мелатонина в крови составляет 30 мин. Основная часть (90%) метаболизируется уже при первом прохождении через печень с образованием 6-сульфатоксимелатонина, который выводится из организма через почки.
Взаимодействие мелатонина с клетками происходит в результате его воздействия на собственные рецепторы, которые расположены в клеточных мембранах практически всех органов и тканей. Кроме того, обладая липофильными и гидрофильными свойствами, мелатонин свободно проходит через клеточные мембраны и воздействует на внутриклеточные процессы путем взаимодействия с ядерными рецепторами и другими субклеточными структурами.
Ритм продукции мелатонина эпифизом имеет четкий циркадианный характер: в темное время суток его концентрация в крови в 5–10 раз выше, чем днем. Уровень мелатонина начинает повышаться в вечернее время, достигая максимума в 2–4 ч ночи, затем постепенно снижается и с 7 ч утра до 8 ч вечера остается очень низким [50]. Угнетающее влияние на продукцию мелатонина оказывают яркое освещение, электромагнитные поля, никотин, алкоголь, кофе, многие фармакологические средства (допамин, бензодиазепины, бета-адреноблокаторы, антагонисты кальция), стимулирующий эффект — ингибиторы обратного захвата серотонина, метионин, стресс.
Кроме суточного, известен сезонный ритм секреции мелатонина. Поздней осенью и зимой в связи с уменьшением освещенности уровень гормона в организме повышается. Весной и летом, наоборот, концентрация мелатонина снижается [33]. Однако при этом сохраняется суточная ритмика образования гормона — минимальный уровень днем и максимальный в ночное время.
Основные физиологические функции мелатонина
Мелатонин обладает широким спектром физиологических функций. Основными из них являются участие в формировании эндогенных биологических ритмов организма, цикла сон — бодрствование, регуляции температуры тела, участие в антиоксидантной защите организма, иммуномодулирующее действие. В последние годы показано влияние мелатонина на функциональное состояние сердечно-сосудистой системы.
Биоритмологические эффекты. Способность адекватно реагировать на различные стимулы путем перестройки биоритмов характеризует стабильность и здоровье организма. Мелатонин осуществляет коррекцию эндогенных ритмов относительно экзогенных ритмов окружающей среды [35]. Биоритмологическая функция мелатонина обеспечивается его непосредственным воздействием на клетки и модулирующим влиянием на секрецию других гормонов и биологически активных веществ, концентрация которых изменяется в зависимости от времени суток. Так, мелатонин угнетает выброс адренокортикотропного гормона, уменьшая в результате концентрацию стрессового гормона кортизола. С участием мембранных рецепторов к мелатонину на нейросекреторных клетках гипоталамуса осуществляется регуляция мелатонином секреции фолликулостимулирующего и лютеинизирующего гормонов, обеспечивающих репродуктивную функцию.
В сезонных перестройках организма основополагающая роль принадлежит связанным с фотопериодом изменениям продукции мелатонина. У лиц с нарушенной сезонной ритмикой секреции мелатонина выше риск развития депрессивных состояний и алкоголизма, а у больных со злокачественными новообразованиями отсутствует сезонная ритмика продукции гормона.
Терморегуляция и индукция сна. Мелатонину принадлежит важная роль в регулировании цикла сон — бодрствование, суточных изменений локомоторной активности и температуры тела. Этот гормон инициирует процесс засыпания. Нарастание его концентрации в крови с наступлением темноты обусловливает ощущение легкой усталости и сонливости [45]. Дальнейшее повышение содержания мелатонина в эпифизе и крови поддерживает необходимую глубину сна. Уровень мелатонина в крови достигает максимума за 1–2 часа до пробуждения. В это время сон человека наиболее глубокий, а температура тела минимальна.
Повышение секреции мелатонина в темное время суток приводит к снижению температуры тела за счет усиления теплоотдачи [17]. Учитывая тесную связь между ритмами температуры тела и продукцией мелатонина, в свое время был предложен косвенный метод оценки мелатонинобразующей функции эпифиза по измерению амплитуды суточного ритма температуры тела: размах показателя менее 0,50С может свидетельствовать о снижении продукции мелатонина.
Антиоксидантные эффекты. Механизм антиоксидантного действия мелатонина обусловлен, прежде всего, способностью связывать образующиеся при перекисном окислении липидов наиболее токсичные гидроксильные радикалы, а также пероксинитрит, оксид азота, синглетный кислород и пероксильный радикал [40]. Мелатонин в опытах in vitro инактивировал гидроксильные радикалы в 5 раз активнее, чем внутриклеточный антиоксидант глютатион. В экспериментах in vitrо и in vivo мелатонин в 2 раза активнее витамина Е. Во-вторых, мелатонин повышает активность основных антиоксидантных ферментов — супероксиддисмутазы, глутатионпероксидазы и глутатионредуктазы, а также угнетает активность прооксидантного фермента NO-синтазы. Сочетание этих механизмов обеспечивает мощный антиоксидантный эффект гормона.
Мелатонин воздействует на свободнорадикальные процессы в любой клетке организма, а не только в клетках, которые имеют рецепторы к мелатонину. Антиоксидантный эффект мелатонина обеспечивает защиту ДНК, липидов и белков от свободнорадикального повреждения [41].
Иммуномодулирующее действие. Мелатонин принимает участие в регуляции функций иммунной системы [30, 36]. Об этом свидетельствует присутствие рецепторов к гормону на иммунокомпетентных клетках вилочковой железы и селезенки, периферических иммунокомпетентных клетках (лимфоциты, нейтрофилы), активирующий эффект мелатонина в отношении выработки этими клетками цитокинов. Удаление эпифиза или подавление секреции мелатонина приводило к уменьшению продукции антител, угнетало пролиферацию в костном мозге клеток-предшественников гранулоцитов и макрофагов. Эти эффекты полностью устранялись введением мелатонина в вечернее время суток.
В пользу тесной взаимосвязи мелатонина и иммунной системы свидетельствуют суточные ритмы изменения количества нейрофилов, Т- и В-лимфоцитов в кровотоке с максимумом в темное время суток, а также сезонные ритмы активности иммунной системы.
Кардиоваскулярные эффекты. В последние годы интенсивно исследуются сердечно-сосудистые эффекты экзогенного мелатонина. У здоровых молодых женщин прием мелатонина в относительно малой дозе (1 мг) приводил к снижению артериального давления и уменьшению сосудистой реактивности [43]. У здоровых молодых мужчин ежедневный вечерний прием 5 мг мелатонина существенно понижал дневной, ночной и среднесуточный уровни артериального давления, способствовал замедлению сердечного ритма [44].
Показано также, что мелатонин понижает уровень в крови холестерина и атерогенных липопротеидов низкой плотности [42].
Регуляция полового развития. Физиологические количества мелатонина оказывают воздействие на синхронизацию репродуктивных функций у видов, зависимых от дневного света [39]. У зародышей и новорожденных млекопитающих этот гормон помогает запрограммировать циркадные ритмы и определяет время начала и окончания полового созревания. Известно, что мелатонин начинает продуцироваться эпифизом вскоре после рождения, его концентрация постепенно увеличивается, достигая максимума в возрасте 7 лет [50]. Резкое снижение уровня гормона в период полового созревания, продолжающееся в среднем до 20-летнего возраста, способствует активации гонадотропной функции гипофиза, выработке фолликулостимулирующего и лютеинизирующего гормонов, которые оказывают стимулирующее влияние на половые железы. Этот механизм обеспечивает включение репродуктивной функции человека. У подростков с более высоким содержанием мелатонина в крови чаще наблюдается задержка полового развития.
Таким образом, эпифизу и образующемуся в нем мелатонину принадлежит важная роль в регуляции многих функций (сон, суточные и сезонные биоритмы, температура тела, активность эндокринных желез, артериальное давление, иммунитет, антиоксидантный статус, углеводный и липидный обмен и др.) Снижение способности эпифиза к выработке мелатонина может приводить к нарушению этих функций, способствовать развитию патологии и, возможно, ускоренного старения. Так, известно, что удаление шишковидной железы приводит у животных к изменениям, свойственным процессу старения. С другой стороны, пересадки эпифизов от молодых животных старым, длительное введение мелатонина или эпифизарного экстракта эпиталамина, наоборот, оказывают геропротекторный эффект, который характеризуется увеличением продолжительности жизни и замедлением возрастных изменений организма [11, 10, 37].
Возрастные изменения секреции мелатонина
Выработка мелатонина эпифизом и его концентрация в крови существенно изменяются в течение жизни [50]. У новорожденных мелатонин циркулирует в крови в ничтожно малых количествах, однако вскоре его концентрация начинает повышаться, достигая максимальных значений в возрасте от 3-х до 7-ми лет. В период полового созревания происходит резкое снижение уровня гормона, которое многие исследователи связывают с уменьшением удельной массы эпифиза при интенсивном росте организма.
Одним из важных аспектов физиологии эпифиза являются изменения его активности при старении. В этом направлении выполнено много исследований, как у животных, так и у людей, однако полученные результаты неоднозначны и нередко противоречивы.
В большинстве исследований отмечено снижение концентрации мелатонина в плазме крови у пожилых и старых людей на 10–50% по сравнению с молодыми [12, 47, 49, 52]. У людей старших возрастов снижена экскреция с мочой основного метаболита 6-сульфатоксимелатонина [24, 50]. Следует отметить, что в этих исследованиях не всегда соблюдались условия, исключающие влияние экзогенных и эндогенных факторов, которые оказывают существенное влияние на функцию эпифиза. В исследуемые группы попадали не только здоровые пожилые люди, но и лица с патологическим типом старения (болезнь Альцгеймера, ишемическая болезнь сердца, гипертоническая болезнь, злокачественные новообразования и др.), пациенты, получавшие транквилизаторы, снотворные средства, бета-адреноблокаторы, антагонисты кальция, употребляющие кофе и алкоголь, которые подавляют активность шишковидной железы. В то же время для изучения собственно возрастных изменений необходимо особенно тщательно отбирать физиологически стареющих людей, не имеющих указанной выше патологии и не получающих фармакологические препараты.
Такие исследования с использованием стандартных протоколов были проведены в конце 90-х годов несколькими группами исследователей [27, 34, 51]. В работе Zeitzer J.M. et al. суточные ритмы концентрации мелатонина в плазме крови изучались у тщательно отобранных здоровых добровольцев. Накануне и в период исследования исключался прием алкоголя, кофе и любых препаратов, оказывающих влияние на функцию эпифиза. Полученные результаты показали отсутствие существенных различий между молодыми и старыми людьми по всем параметрам эндогенного суточного ритма концентрации мелатонина [51]. Однако у части людей старшего возраста был выявлен низкий уровень мелатонина в плазме крови.
В другом исследовании у 253 людей в возрасте от 21 до 82 лет изучалась ночная экскреция с мочой 6-сульфатоксимелатонина. Авторы показали, что снижение экскреции метаболита происходит в основном в 3-й декаде жизни, а не в последующий период. Тем не менее, при сопоставлении молодых и старых людей у последних отмечено отчетливое уменьшение экскреции 6-сульфатоксимелатонина [27].
Проведенное нами изучение концентрации мелатонина в плазме крови у здоровых людей молодого и пожилого возраста показало, что у последних концентрация гормона в разное время суток существенно ниже, чем у молодых (Диаграмма №1). У большинства лиц пожилого возраста (71%) функциональная активность железы снижена. У них концентрация мелатонина днем меньше 10 пг/мл, ночью — менее 30 пг/мл, амплитуда суточного ритма мелатонина не превышает 20 пг/мл. В то же время у каждого третьего пожилого человека уровень мелатонина в крови высокий, и амплитуда суточного ритма гормона такая же, как у молодых людей, что свидетельствует о сохранении мелатонинобразующей функци эпифиза.
Высокая функциональная активность эпифиза является благоприятным фактором для поддержания удовлетворительной жизнеспособности. Так, долгожители имеют достаточно высокую концентрацию мелатонина в плазме крови [19], в то время как больные с выраженной патологией (болезнь Альцгеймера, злокачественные новообразования, инфаркт миокарда, депрессия) имеют низкие уровни мелатонина в крови или экскреции с мочой 6-сульфатоксимелатонина [20, 22, 23, 46].
У обследованных нами практически здорових пожилых людей индивидуальные различия суточных ритмов мелатонина обусловлены неодинаковым функциональным состоянием организма, которое оценивали по результатам выполнения пробы с физической нагрузкой. Так, у лиц со сниженной мелатонинобразующей функцией эпифиза (низкоамплитудный ритм мелатонина) переносимость физической нагрузки существенно меньше, чем у людей с сохраненной функцией эпифиза (высокоамплитудный ритм мелатонина). Функциональный возраст сердечно-сосудистой системы и его разница по отношению к календарному возрасту достоверно больше у обследованных с малой амплитудой ритма мелатонина.
Это свидетельствует о том, что высокую функциональную активность эпифиза имеют пожилые люди, у которых менее выражены возрастные изменения сердечно-сосудистой системы и организма в целом.
Фармакологические эффекты мелатонина
В практическое здравоохранение мелатонин внедрен около 20 лет назад. За этот период накоплен достаточный опыт использования препарата в трех областях клинической медицины — неврологии (снотворный эффект), онкологии (онкостатический и иммуномодулирующий эффект) и профилактической медицине (биоритмо-регулирующий эффект).
Снотворное действие. Наиболее исследован снотворный эффект мелатонина, который наблюдается в весьма широком диапазоне доз и возникает даже после приема весьма небольших количеств препарата (0,1–0,3 мг). Многие исследователи считают мелатонин достаточно сильным снотворным средством, преимущество которого состоит в том, что он лишен побочных эффектов, которые характерны для других препаратов данной группы [42,45,48,53]. Повышение концентрации мелатонина в плазме крови является естественным стимулом к засыпанию [45]. Доказана высокая эффективность вечернего приема мелатонина у больных с синдромом задержки фазы сна, которые не могут уснуть до раннего утра. Установлена достаточная эффективность мелатонина при семейной инсомнии и нарушениях сна у детей. Одновременно у больных улучшалось настроение и повышалась устойчивость к психоэмоциональному стрессу.
Используемые для лечения бессонницы бензодиазепины (седуксен, сибазон, реланиум и др.) вызывают эффект последействия, проявляющийся утренней сонливостью, мышечной слабостью, утомляемостью, снижением концентрации внимания, головокружением и др. побочными эффектами. К этим препаратам развивается привыкание. Они нарушают суточную ритмику образования мелатонина, в частности угнетают ночной пик его секреции, что отрицательно влияет на естественные механизмы сна [48].
Механизм действия мелатонина принципиально отличается от механизма действия традиционных снотворных препаратов. Мелатонин вызывает сон, воздействуя на терморегуляторные процессы [17]. Уменьшая температуру тела, он увеличивает потребность во сне и снижает мотивацию к бодрствованию. Наиболее выраженный снотворный эффект экзогенного мелатонина отмечается в тех случаях, когда бессонница сочетается с недостаточным ночным понижением температуры тела вследствие сниженной продукции мелатонина [53]. Прием препарата может улучшить сон и в том случае, если больной принимает препараты, достоверно снижающие продукцию мелатонина, например, бензодиазепины или бета-адреноблокаторы.
Преимуществом мелатонина при лечении бессонницы является то, что он сохраняет или восстанавливает естественную структуру сна (чередование фаз медленного и быстрого сна, их длительность). Другим его достоинством является незначительное негативное влияние на способность управлять транспортным средством, что было показано в исследованиях с использованием специальных компъютерных тестов.
Особенности снотворного действия мелатонина важны для лечения бессонницы у людей пожилого возраста, у которых нарушена физиологическая структура и снижена общая длительность ночного сна, имеет место наклонность к раннему пробуждению [21].
Проведенный нами у 60 пожилых больных анализ эффективности вечернего приема мелатонина (3 мг в течение 2-х недель) выявил существенное улучшение качества сна у 75% обследованных. Уменьшилось время засыпания, количество пробуджений ночью, увеличилась продолжительность сна, отсутствовала утренняя вялость, улучшились настроение и работоспособность. Переносимость препарата, как правило, хорошая. В единичных случаях (до 3%) на фоне приема мелатонина наблюдалась сухость во рту, головная боль, у 2-х больных ухудшился сон.
Для получения снотворного эффекта важен правильный выбор времени приема мелатонина — оно должно совпадать с началом вечернего подъема продукции гормона. При приеме мелатонина в светлый период суток отмечается сонливость и усталость, происходит снижение психомоторной работоспособности. Поэтому, чтобы не нарушать профессиональную деятельность человека, мелатонин не следует принимать в утренние и дневные часы.
Таким образом, лечение бессонницы мелатонином необходимо начинать с минимальных доз препарата (0,1–0,3 мг), постепенно увеличивая их до получения снотворного эффекта. Препарат следует принимать в вечернее время, за 1–2 часа до сна [13, 48]. Лечение должно проводиться по назначению врача.
Коррекция биологических ритмов. Мелатонин способствует перестройке биологических ритмов организма в соответствии с новым режимом дня [28, 35, 48]. Поэтому он является препаратом выбора при лечении синдрома дезадаптации к смене часовых поясов у авиапассажиров, перемещающихся на значительные расстояния. Мелатонин также может использоваться для синхронизации желаемого времени сна с внешней циркадной фазой у сменных рабочих, чья профессиональная деятельность приходится на ночь [ 35].
У жителей умеренной и полярной зон наблюдается отчетливая тенденция к замедлению ритма циркадной системы зимой вследствие недостаточного освещения. Вечерний прием мелатонина индуцирует фазовое ускорение циркадных ритмов, что в зимнее время приводит к улучшению самочувствия, настроения и качества сна.
Онкостатическое действие. Предпосылками к использованию мелатонина в онкологии явились экспериментальные исследования, которые продемонстрировали его способность в физиологических дозах тормозить рост некоторых линий опухолевых клеток [14]. Показано также, что параллельно с опухолевым ростом происходит прогрессирующее снижение продукции эпифизом мелатонина [3, 23, 48]. В эпидемиологических исследованиях и при изучении результатов вскрытий выявлено, что в тех странах, где часто встречается рак молочной железы, более широко распространена кальцификация шишковидной железы и снижен уровень мелатонина, в отличие от регионов, где заболевание встречается относительно редко.
В эксперименте показано, что мелатонин оказывает влияние на количество и активность рецепторов к эстрогенам, и таким образом может останавливать рост клеток рака молочной железы [14]. В связи с этим изучался эффект добавления мелатонина больным, у которых метастазы рака молочной железы были резистентны к базисной противоопухолевой терапии. Мелатонин (20 мг на ночь) использовался ежедневно в сочетании с тамоксифеном (20 мг во второй половине дня) в течение 8 месяцев. Во всех случаях переносимость терапии была удовлетворительной, прием мелатонина не усиливал токсические эффекты тамоксифена. Более половины больных отмечали улучшение самочувствия. Онкостатический эффект терапии мелатонином наблюдался у 30% пациенток. В процессе лечения достоверно снижался уровень инсулин-зависимого фактора роста-1, который относится к факторам роста рака молочной железы. На основании этих предварительных результатов авторы считают, что прием мелатонина может способствовать регрессии метастазов рака молочной железы в случае резистентности к монотерапии тамоксифеном [31]. В последующих исследованиях показано, что мелатонин предупреждает развитие тромбоцитопении у получающих химиотерапию больных с метастазами рака молочной железы и вызывает регресс опухолевого роста у 41% больных [32]. Эти исследования позволили рекомендовать мелатонин в схемы комплексной терапии больных раком молочной железы [26].
Другие фармакологические эффекты мелатонина, которые перечислены ниже, находятся в стадии экспериментального или клинического изучения. При их подтверждении мелатонин может оказаться перспективным препаратом в ряде отраслей клинической медицины — кардиологии, неврологии, геронтологии и гериатрии.
Гиполипидемическое и гипотензивное действие. В эксперименте мелатонин препятствовал росту уровня холестерина и образованию атеросклеротических бляшек на внутренней стенке артерий. У людей мелатонин уменьшал содержание общего холестерина и концентрацию в крови атерогенных липопротеидов низкой плотности [42]. Однократный прием мелатонина снижал артериальное давление по данным суточного мониторирования [4], а длительное введение препарата приводило к устойчивому уменьшению артериального давления у больных с артериальной гипертонией [43].
По данным наших исследований 2-недельный вечерний прием мелатонина в дозе 3 мг приводил к понижению концентрации холестерина и бета-липопротеидов в сыворотке крови у 22 пожилых людей с дислипопротеидемией (индекс атерогенности выше 4), однако не оказывал влияния на липиды крови при нормальных показателях.
У пожилых людей без артериальной гипертонии (АД менее 140/90 мм рт.ст.) при суточном мониторировании АД мы наблюдали достоверное снижение систолического и диастолического АД в ранние утренние часы после курсового вечернего приема 3 мг мелатонина [6].
Стресс-протекторный эффект. Прием мелатонина в дозе 1–10 мг в спокойной обстановке в затемненном помещении быстро снимает стрессорное напряжение, вызывает ощущение легкой усталости и сонливости, затормаживает вегетативные функции, снижает температуру тела [13, 17, 45, 48]. В механизме противострессорной активности мелатонина существенная роль принадлежит уменьшению тонуса симпатической нервной системы, снижению активности гипофизарно-надпочечниковой системы.
У людей пожилого возраста стресс-протекторные эффекты экзогенного мелатонина ранее не изучались, что послужило основанием к оценке влияния мелатонина на реакцию сердечно-сосудистой системы при дозированных стрессовых нагрузках. Исследования проведены нами у 40 пожилых людей, которые по результатам предварительного тестирования имели избыточную реакцию систолического (более чем на 20 мм рт.ст.) и диастолического артериального давления (более чем на 10 мм рт.ст.) при дозированной психоэмоциональной нагрузке.
Результаты исследования показали, что у пожилых людей однократный (3 мг в 10 ч утра) и курсовой прием мелатонина (3 мг вечером за 30 мин до сна в течение 2-х недель) уменьшает не только абсолютные значения систолического и диастолического АД на высоте стрессовых нагрузок, но и прирост этих показателей.
Это свидетельствует о стресс-протекторном эффекте мелатонина. Следует отметить, что у пожилых гиперреакторов относительно небольшая доза мелатонина уменьшает прирост АД при стрессе в такой же степени, как терапевтическая доза блокатора медленных кальциевых каналов нифедипина (10 мг) или ингибитора АПФ каптоприла (25 мг) [7]. В то же время у лиц, реагировавших на психоэмоциональный стресс адекватным повышением АД, мелатонин не оказывал влияния на стрессовую реакцию сердечно-сосудистой системы.
Воздействие на репродуктивную функцию. В фармакологических дозах мелатонин оказывает, в основном, подавляющее воздействие на репродуктивную функцию человека. Путем введения 80–300 мг препарата можно частично подавить пик секреции лютеинизирующего гормона. В связи с этим мелатонин был использован в качестве противозачаточного средства в комбинации с прогестином [9]. Однако применение мелатонина в этой области медицины требует дальнейшего изучения и пока не может быть рекомендовано для широкого клинического применения, так как высокие дозы гормона угнетают синтез эндогенного мелатонина и изменяют биологические ритмы организма. Прием мелатонина противопоказан женщинам, желающим забеременеть, и подросткам.
Профилактика ускоренного старения и возраст-зависимой патологии. Возрастным изменениям функциональной активности эпифиза и секреции мелатонина принадлежит существенная роль в процессах старения. В 1959 г. было показано, что удаление эпифиза у молодых животных приводит к существенному уменьшению продолжительности жизни. В 1960 г. К. Пархон сообщил о продлении жизни старых крыс путем введения вытяжки из эпифиза. В 70-80-е гг. установлено, что полипептидный экстракт эпифиза эпиталамин увеличивает репродуктивный период и среднюю продолжительность жизни животных на 25% [2, 6, 9, 11].
В других исследованиях показано, что введение эпиталамина в утренние часы увеличивает продукцию эпифизом мелатонина в темное время суток [9]. В 1987 г. швейцарские исследователи W.Pierpaoli и G.J.M.Maestroni сообщили о том, что старые мыши, которым с питьевой водой на ночь давали мелатонин, жили на 20% дольше контрольных [37].
Среди возможных механизмов геропротекторного действия мелатонина ведущее значение придается его участию в обезвреживании токсичных свободных радикалов, повышению активности антиоксидантных ферментов [40, 41]. Мелатонин уменьшает образование в организме агрессивных метаболитов канцерогенов и снижает их мутагенную активность. Этот гормон стимулирует клетки иммунной системы, устраняет нарушения липидного обмена, продлевает циклическую деятельность яичников у самок мышей и крыс, восстанавливает репродуктивную функцию у старых животных [1–3, 6, 9]. Важным свойством является способность мелатонина предупреждать развитие спонтанных и индуцируемых химическими канцерогенами и ионизирующей радиацией новообразований.
В настоящее время большинство исследователей считают, что способность эпифиза к синтезу мелатонина снижается при старении. С дефицитом мелатонина могут быть связаны такие возрастные изменения, как нарушение длительности и структуры сна, повышенная хрупкость костей, рост артериального давления, ухудшение памяти, дислипопротеидемия, некоторые возрастные дисфункции иммунной системы, снижение устойчивости организма к стрессовым воздействиям. В связи с этим в перспективе мелатонин может оказаться эффективным средством лечения и профилактики преждевременного старения и ряда возраст-зависимых заболеваний.
В последние годы появились сообщения об отсутствии существенных изменений функции эпифиза в пожилом возрасте. Это определило более сдержанный подход к назначению мелатонина людям пожилого и старческого возраста, страдающим расстройствами сна, депрессивными нарушениями. Например, в рекомендациях специалистов Национального центра старения США указывается на необходимость предварительной оценки мелатонинобразующей функции эпифиза перед тем, как будут назначены препараты, модифицирующие активность шишковидной железы. Бесконтрольное применение мелатонина для профилактики ускоренного старения, которое широко практиковалось в США в 90-е годы, в настоящее время признано преждевременным, не имеющим серьезных научных оснований [15, 16, 25]. Однако дальнейшие исследования в этом направлении представляют значительный научный и практический интерес.
При назначении мелатонина необходимо учитывать эндогенные ритмы функционального состояния эпифиза. При неправильном определении времени введения препарата или использовании неадекватно большой его дозы существует вероятность неблагоприятного угнетающего воздействия на функциональную активность эпифиза, чрезмерного торможения психофизиологических функций организма.
Безопасным можно считать вечерний прием препарата, синхронизированный с началом физиологического подъема секреции мелатонина эпифизом (20–21 ч). При терапии бессонницы и для коррекции нарушенных биоритмов лечение необходимо начинать с минимальных, физиологических доз препарата (0,1–0,3 мг), постепенно увеличивая их до получения стабильного эффекта. В онкологии мелатонин целесообразно использовать в более высоких, фармакологических дозах (20–100 мг/сутки) на фоне базисной химио- и гормональной терапии. Для лечения больных с артериальной гипертонией и гиперхолестеринемией используются средние дозы препарата (1–10 мг).
Подходы к коррекции мелатонинобразующей функции эпифиза в пожилом возрасте
Проведенные в последние годы экспериментальные исследования расширили знания о механизмах снижения мелатонинобразующей функции эпифиза при старении. Если раньше его связывали с кальцификацией железы и уменьшением количества пинеалоцитов [39], то в настоящее время все больше исследователей отмечают функциональный характер изменения активности эпифиза в старости. С возрастом уменьшается плотность бета-адренорецепторов на поверхности пинеалоцитов, нарушается их взаимодействие с норадреналином, снижается образование цАМФ в клетках железы при адренергической стимуляции [3, 29, 47, 49].
В связи с этим изменяются представления о возможных путях коррекции функционального состояния эпифиза при патологии и старении. Так, если кальцификация железы и потеря пинеалоцитов предполагают проведение заместительной терапии мелатонином, то концепция о функциональном характере изменений активности эпифиза открывает перспективу для использования воздействий, направленных на восстановление способности железы продуцировать собственный мелатонин. Это могут быть такие влияния, как введение экстрактов эпифиза или их синтетических аналогов, например, эпиталамина или эпиталона, отказ от приема лекарственных препаратов, подавляющих выработку мелатонина (бета-адреноблокаторы, нестероидные противовоспалительные препараты, кофеин, бензодиазепины, снотворные и др.), уменьшение или устранение факторов, которые подавляют функциональную активность пинеальной железы (психоэмоциональные стрессы, курение, злоупотребление алкоголем и др.).
Однако эффективность воздействий на функциональную активность эпифиза у людей пожилого возраста ранее не изучалась, что явилось поводом к проведению наших исследований.
Мелатонинобразующую функцию эпифиза мы оценивали на основании определения концентрации мелатонина в плазме крови радиоимунным методом (наборы компании DPC, США) в разное время суток — в 9 ч. утра, 15 ч. дня, 21 ч. вечера и 3 ч. ночи. После проведения фонового исследования пожилых людей разделили на три группы. 9 чел. получали лечение мелатонином (3 мг ежедневно вечером за 30 мин до сна в течение 2-х недель), 12 чел. назначали полипептидный экстракт эпифиза — фармакологическое средство Эпиталамин (10 мг в 2 мл физиологического раствора утром 1 раз в 3 дня, 5 иньекций на курс), 10 чел. получали плацебо (2 мл физиологического раствора внутримышечно 1 раз в 3 дня, 5 иньекций). После лечения у каждого пациента повторно определяли суточный ритм концентрации мелатонина в плазме крови.
Экзогенный мелатонин
Полученные нами результаты показали отсутствие достоверного влияния плацебо на суточный ритм и ночной пик концентрации мелатонина в плазме крови.
В результате курсового введения мелатонина у 7-ми из 9-ти пожилых людей концентрация мелатонина в 3 ч ночи, через 5–6 ч после вечернего приема препарата, в 10 раз превышала исходный уровень и была почти в 2 раза выше, чем у молодых людей (см. рис. 1). Из этого следует, что экзогенный мелатонин может использоваться в пожилом возрасте для заместительной терапии при функциональной недостаточности эпифиза. Однако у некоторых пожилых людей вследствие вечернего приема 3 мг мелатонина формируется очень высокий ночной пик гормона в плазме, который не характерен для пожилых людей с сохраненной функцией эпифиза. Поэтому для заместительной терапии после 60 лет мелатонин, по-видимому, следует назначать в меньшей дозировке, например 0,3–1 мг.
Наряду с этим обращает внимание большая индивидуальная вариабельность изменения уровня мелатонина в плазме крови под влиянием стандартной дозы мелатонина. Так, в 3 ч ночи прирост концентрации гормона у пожилых составил от 33,6 пг/мл до 568,1 пг/мл, что связано с индивидуальными особенностями фармакокинетики препарата. Кроме того, у 2 из 9 пожилых людей на фоне приема мелатонина наблюдалось парадоксальное снижение концентрации гормона в плазме. Возможно, под влиянием экзогенного мелатонина у некоторых людей происходит угнетение продукции эндогенного мелатонина по механизму отрицательной обратной связи.
Таким образом, под влиянием курсового приема мелатонина (3 мг внутрь за 30 мин до сна) у пожилых людей происходит многократное повышение ночного пика концентрации мелатонина в плазме крови. Вследствие этого низкоамлитудный суточный ритм мелатонина трансформируется в высокоамплитудный ритм, который обычно наблюдается у молодых людей.
Полипептидный экстракт эпифиза эпиталамин
В последние годы все большее внимание исследователей привлекает использование для коррекции возрастных изменений препаратов, полученных из шишковидной железы [6]. Одним из них является производимый в России фармакологический препарат Эпиталамин (полипептидный экстракт из эпиталамо-эпифизарной области мозга телят). Эпиталамин хорошо зарекомендовал себя как геропротекторное средство (увеличение продолжительности жизни животных, антиоксидантное действие, коррекция нарушений липидного и углеводного обмена, иммуномодулирующее действие, повышение физической и умственной работоспособности, снижение функционального возраста организма [1, 5, 6, 9–11]. Полагают, что геропротекторное действие эпиталамина опосредовано повышением функциональной активности эпифиза, что подтверждено в эксперименте на животных [44]. Однако оставалось неизвестно, оказывает ли эпиталамин коррегирующее влияние на функцию эпифиза у людей пожилого возраста.
В проведенном нами исследовании установлено, что эффект влияния эпиталамина на мелатонинобразующую функцию эпифиза у пожилых людей отчетливо зависит от исходной концентрации мелатонина в плазме крови до лечения. Поэтому действие препарата оценивалось отдельно в подгруппах людей с сохраненной (4 чел.) и сниженной мелатонинобразующей функцией эпифиза (8 чел.). У лиц с сохраненной мелатонинобразующей функцией эпифиза концентрация мелатонина в плазме крови ночью составляла (149,6±42,2) пг/мл, днем — (6,7±1,8) пг/мл, амплитуда суточного ритма — (142,9±35,4) пг/мл, соотношение между концентрацией гормона ночью и днем — 22,3. У всех людей этой подгруппы эпиталамин уменьшил концентрацию мелатонина в плазме в 3 ч ночи.
У 8 пожилых людей со сниженной мелатонинобразующей функцией эпифиза концентрация мелатонина в плазме ночью до лечения составляла (24,2±5,1) пг/мл, днем — (4,1±1,1) пг/мл, амплитуда суточного ритма — (20,1±4,6) пг/мл, соотношение между ночной и дневной концентрацией гормона — 5,9. Под влиянием эпиталамина в этой подгруппе концентрация мелатонина ночью достоверно возросла более чем в 2 раза — от (24,2±5,1) пг/мл до (59,0±12,6) пг/мл (p