когда можно вакцинироваться вакциной чумакова
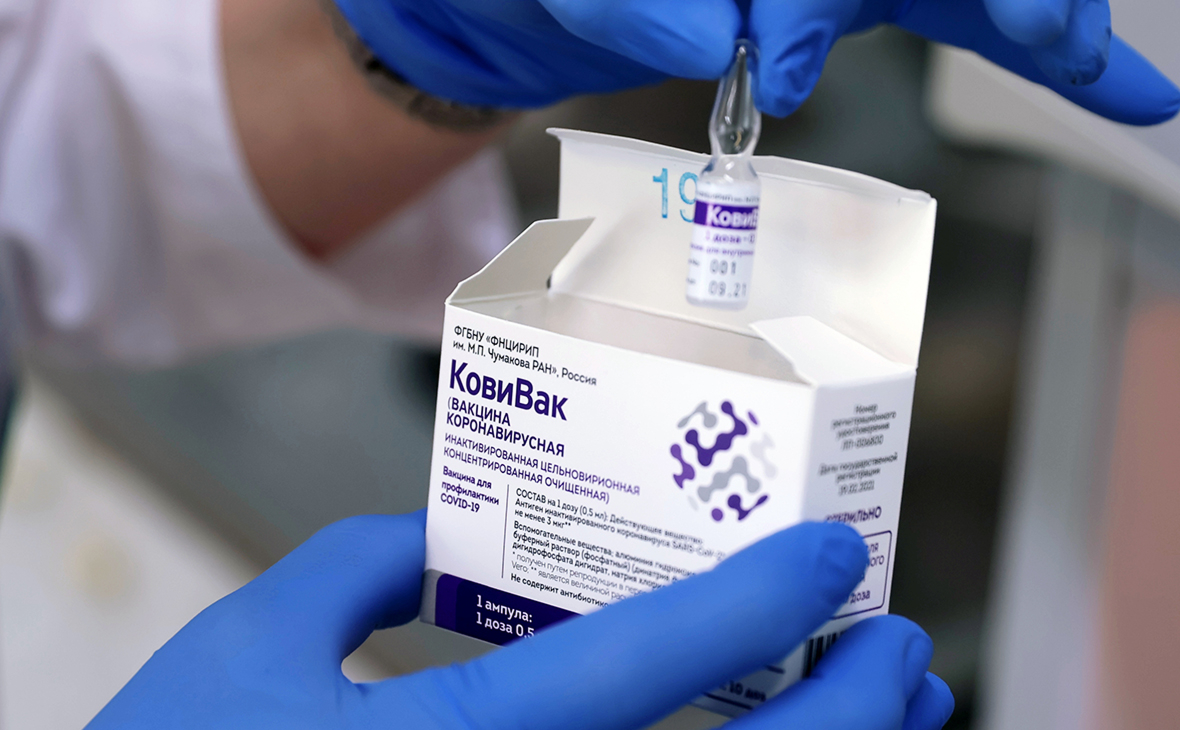
Вакцина «КовиВак» поступила в регионы. Чем она отличается от других
Вакцина «КовиВак» Центра им. Чумакова была зарегистрирована в России в конце февраля, о чем тогда же объявил на заседании правительства премьер-министр Михаил Мишустин. Министр здравоохранения Михаил Мурашко заверил, что вакцина во время клинических испытаний показала безопасность и эффективность. Промышленное производство «КовиВака» было запущено в конце марта в присутствии главы Минобрнауки Валерия Фалькова, выпуск вакцины в гражданский оборот был анонсирован в ближайшее время.
Клинические испытания «КовиВака», как и двух других отечественных разработок — «Спутника V» Центра им. Гамалеи и «ЭпиВакКороны» центра «Вектор» Роспотребнадзора, — проходили в формате смешанной I—II фаз, а регистрация была выдана «на условиях», определенных постановлением правительства (№ 441). Это значит, что разработчик обязан после регистрации провести полномасштабные клинические исследования в рамках III фазы.
В каких регионах уже сейчас можно привиться «КовиВаком», чем платформа этой вакцины отличается от других и когда начнется III фаза клинических испытаний, разбирался РБК.
В каких регионах уже есть «КовиВак»
О том, что «КовиВак» до 25 апреля появится в поликлиниках 18 регионов, Минобрнауки, которому подведомственен Центр им. Чумакова, сообщало в 20-х числах апреля. Первые дозы вакцины, как ожидалось, получат Ленинградская область, Московский регион, Татарстан, Ставрополье и Приморский край.
Остальные 13 регионов в сообщении не раскрывались. Запрос РБК о том, в какие именно регионы будет поставлена вакцина, Минобрнауки переадресовало в Минздрав, сославшись на постановление правительства, согласно которому именно это ведомство распределяет лекарственные препараты между регионами. В пресс-службе Минздрава не ответили на запрос РБК. РБК также направил запрос в компанию «Нацимбио» (входит в «Ростех»), к которой с весны этого года перешли полномочия по поставке вакцин в регионы.
В ответ на запросы местные департаменты здравоохранения и минздравы РБК сообщили следующее.
Сейчас в России нет ограничений для вакцинации по месту регистрации, отмечает в разговоре с РБК советник мэра Москвы по социальным вопросам Леонид Печатников. «Российский гражданин имеет право привиться в любом регионе, но сомневаюсь, что есть гарантии привиться именно вакциной Центра им. Чумакова, просто потому, что пока ее произведено немного», — сказал он.
В чем отличие платформы «КовиВака»
В основе «КовиВака» находится инактивированный (или «убитый») цельный вирус SARS-CoV-2, тогда как «Спутник V» — векторная вакцина, где в качестве вектора задействованы два разных типа аденовируса человека: в них встроен фрагмент гена SARS-CoV-2, который кодирует один из белков вируса, а именно S-белок. В случае с «ЭпиВакКороной» речь идет о пептидной платформе, состоящей из искусственно синтезированных фрагментов того же S-белка SARS-CoV-2.
В случае прививки «КовиВаком», поясняет заведующий отделом общей вирусологии Центра им. Чумакова Георгий Игнатьев, у иммунной системы человека формируется спектр антител ко всем структурным белкам SARS-CoV-2, а не только к S-белку. «Мы обнаруживаем иммунный ответ к нуклепротеину, S-белку и фрагменту S-белка RBD», — говорит он. Каждый белок вируса имеет определенную функцию, чтобы, попав в клетки человека, заразить их, сделать копии себя. Вакцина Центра им. Чумакова дает более выраженный спектр антител, говорит Игнатьев, чем «Спутник V» и «ЭпиВакКорона».
Инактивация, или «убийство» живого вируса, происходит после его 48-часового взаимодействия с химическим реактивом бета-пропиолактоном, он делает РНК коронавируса неинфекционной, сохраняя антигенные свойства поверхностных белков, однако вирус уже не сможет распространяться в организме человека. В качестве адъюванта (усилителя иммунного ответа) в вакцине используется гидроокись алюминия. Игнатьев поясняет, что благодаря ей инактивированный вирус дольше и лучше «представляется» иммунной системе человека после введения вакцины.
В Центре им. Чумакова используется особая процедура оценки полноты инактивации вируса, которая должна подтвердить, что в инактивированном вирусе нет остаточной инфекционности. Только если ученые после многоэтапной проверки убедились в полноте инактивации вируса, материал, то есть вирусный антиген, поступает на следующий этап производства.
Каким может быть иммунный ответ
Когда в организм вводится вакцина, то есть чужеродный белок, он должен быть распознан иммунной системой. Этот белок должны «подхватить» антигенпрезентующие клетки организма и «представить» другим клеткам, которые отвечают за разные звенья иммунного ответа, объясняет научный консультант лаборатории Genetico Екатерина Померанцева.
В ответ на это «представление» антигенов B-клетки вырабатывают иммуноглобулины (то есть антитела), а T-клетки превращаются в цитотоксические лимфоциты, или «Т-киллеры». В каком бы виде антиген ни был запущен в организм (цельного белка либо его частей), то, на что организм будет вырабатывать антитела или Т-клетки, — это уже «обломки» белка.
Возможные недостатки и преимущества «КовиВака»
Опрошенные РБК эксперты обращают внимание на то, что нельзя только лишь на основании типа платформы той или иной вакцины говорить о силе иммунного ответа на нее. Кроме того, человеческий организм может вырабатывать как защитные антитела к вирусу, которые способны его нейтрализовать, так и антитела, которые не будут давать никакой степени защиты вовсе. Эксперты сходятся на том, что эффективность вакцины можно оценить только после проведения клинических испытаний, в том числе полномасштабной III фазы — она у «КовиВака» начнется в ближайшем будущем.
Такая же платформа, как у «КовиВака», используется в двух китайских вакцинах — компаний Sinovac и Sinopharm, а также в казахстанской вакцине QazVac.
Эксперты отмечают следующие проблемы вакцин на платформе цельного «убитого» вируса.
Так как внутри «КовиВака» есть сразу три структурных белка вируса (нуклеопротеин, S-белок и его фрагмент RBD), организм должен «отреагировать» выработкой антител на все три части вируса. Сейчас можно говорить о том, что антитела к S-белку и RBD в его составе обладают защитными свойствами, говорит Екатерина Померанцева. А вот антитела к нуклеопротеину могут оказаться незащитными, допускает она, в таком случае антитела к этому фрагменту белка не будут снижать риск заболеть.
По словам заведующего лабораторией Института молекулярной биологии им. В.А. Энгельгардта Александра Иванова, действительно важны нейтрализующие антитела, которые могут «узнать» и устранить тот фрагмент белка коронавируса, который первично взаимодействует с клеткой человека, — S-белок и его фрагмент RBD. «Антитела, которые вырабатываются к нуклеопротеину, незащитные, их выработка — просто следствие того, что наш организм познакомился с этим фрагментом антигена», — поясняет он.
Антителозависимое усиление инфекции — эффект, который в теории может иметь место после повторного заражения или после вакцинации. В таком случае с вирусом взаимодействуют незащитные антитела, которые, вместо того чтобы блокировать его распространение, будут, наоборот, способствовать размножению вируса в клетке.
Незащитные антитела или антитела, вырабатывающиеся в недостаточном количестве к отдельным белкам в составе вируса, могут в теории вызывать ADE-эффект, если такие антитела не проверяли по отдельности, обращает внимание Померанцева. Но в случае с коронавирусом, продолжает она, этот риск теоретический — на практике при SARS-CoV-2, этот эффект у людей не наблюдали.
На сегодняшний день действительно не зафиксировано ни одного случая этого эффекта ни для одной из существующих вакцин. Для того чтобы определить, представляет ли какая-либо вакцина риск возникновения ADE-эффекта, потребуются отдельные клинические испытания.
При этом эксперты говорят о следующих преимуществах прививки вакциной с цельным «убитым» вирусом.
В такой логике, говорит Иванов, вакцина Центра им. Чумакова действительно может гарантировать оба иммунных ответа — гуморальный (антительный) и клеточный (за счет «Т-киллеров»). «С точки зрения архитектуры вакцины более полный спектр ответа будет шире как раз для цельновирионных вакцин, чем для тех, которые иммунизируют одним белком или его частью», — подтверждает он. Среди других достоинств разработки Центра им. Чумакова он называет прозрачность и логичность ее создания.
Заведующий отделом общей вирусологии Центра им. Чумакова Георгий Игнатьев, в свою очередь, настаивает, что иммунный ответ, который развивается на введение инактивированных вакцин, не может быть либо гуморальным, либо клеточным, так как на вакцину «отвечает» и то и другое звено иммунитета.
Резюмируя, Померанцева замечает: несмотря на то что не все аспекты тех или иных защитных свойств вакцин сейчас изучены, все вакцины, прошедшие клинические испытания, дают защиту от смертельной формы болезни.
В чем особенности производства «КовиВака»
На сегодняшний день производит, разливает и упаковывает вакцину сам разработчик — Центр им. Чумакова. При разработке центр работает с живым SARS-CoV-2, который имеет вторую группу патогенности; для работы с ним важно соблюдение определенных условий безопасности, рассказывает Георгий Игнатьев. Год назад, когда было принято решение о разработке вакцины, в центре планировали масштабирование только исходя из собственного производства, продолжает он.
«Мы произвели 750 тыс. доз с момента регистрации вакцины. Эти дозы прошли контроль качества и уже вышли в оборот — отправлены в регионы», — сказал Игнатьев. У центра есть намерение наладить вторую производственную линию, чтобы увеличить объем производства, но проблема заключается в том, что дополнительное оборудование получено еще не полностью, добавил он.
Как планируется расширять производство
Помочь с масштабированием должна компания «Нанолек», говорил гендиректор Центра им. Чумакова Айдар Ишмухаметов. Первый заместитель гендиректора компании «Нанолек» Максим Стецюк так описывает будущую схему взаимодействия с учеными: в центре в биореакторах наращивается объем живого вируса SARS-Cov-2, это занимает одну-две недели, далее эта масса «убивается», очищается, из нее выделяется активная субстанция, это практически готовая вакцина.
С этой уже непатогенной субстанцией можно работать в обычных фармацевтических условиях на заводе «Нанолек», она ставится на линию, разливается в первичную упаковку — флакон, упаковывается в пачку с инструкцией — так получается готовый продукт. При этом стадия розлива должна соответствовать всем необходимым стандартам и техническим регламентам. Так как «Нанолек» — контрактная площадка для Центра им. Чумакова, произведенная вакцина возвращается в центр, который проверяет ее качество и выпускает на рынок.
Производство в центре работает по принципу «один флакон — одна доза», объясняет Игнатьев; при этом «Нанолек» может произвести один флакон, внутри которого будет минимум 5 доз, что в условиях эпидемии более важно.
Однако сам «Нанолек», говорит Стецюк, не может работать с живым вирусом, для этого необходимо было бы построить отдельный завод, поэтому компания ждет наработанной субстанции вируса от центра. Центр же может произвести лишь ограниченный объем субстанций, поскольку вакцина «капризна», а мощность биореактора ограничена. В итоге по плану до конца года «Нанолек» произведет лишь 5 млн доз, хотя разлить вакцины компания могла бы больше, говорит Стецюк.
«Физически розлив мы начнем в августе, сейчас идут регуляторные процедуры — «Нанолек» добавляется в регистрационное удостоверение Центра им. Чумакова, это согласовывается Минздравом. Мы рассчитываем, что в конце июля это обновленное удостоверение будет выдано, тогда мы юридически сможем выпускать вакцину «КовиВак» на своих мощностях в Кирове», — заключает он.
Что осталось сделать
Центр им. Чумакова уже подал документы в Минздрав на получение разрешения на III фазу клинических исследований и ожидает ответа от министерства. Как уточняет Георгий Игнатьев, протоколом исследования предусмотрено включение в него около 30 тыс. человек. В рамках III фазы центр продолжит оценивать безопасность, переносимость и эффективность вакцины у добровольцев от 18 до 60 лет; в исследования также предполагается включить группу 60+ и три дополнительные фокусные группы: люди с хронической обструктивной болезнью легких (ХОБЛ), онкологическими и ревматологическими заболеваниями. В итоге исследование займет год.
Вакцина с убитым коронавирусом. Журналист 59.RU — об опыте ревакцинации дефицитным «КовиВаком»
Тимур Хусаинов рассказывает, чем эта вакцина отличается от других и как он перенес новую прививку
«КовиВак» хранят в обычном холодильнике при плюсовой температуре
Фото: Сергей Федосеев
«КовиВак» — одна из самых дефицитных и малоизученных российских вакцин от COVID-19. Ее разработали в Федеральном центре исследований и разработки иммунобиологических препаратов имени Чумакова. В Пермский край поступило немногим более 2000 ее комплектов. При этом спрос на вакцину явно превышает ее наличие — многие пермяки хотят поставить именно «КовиВак» из-за того, что она изготовлена по «классическому рецепту». Журналист 59.RU Тимур Хусаинов проверил «КовиВак» на себе, ревакцинировавшись ею после «Спутника V».
Как вакцина работает в теории
Центр имени Чумакова известен тем, что в нем производится вакцина от полиомиелита, которую поставляют в разные страны под эгидой Всемирной организации здравоохранения (ВОЗ). Центр был создан в 1957 году на базе Института полиомиелита и вирусных энцефалитов. Кроме вакцины от полиомиелита в нем были созданы отечественные вакцины от клещевого энцефалита, бешенства и желтой лихорадки.
Перед вакцинацией мне измерили давление и температуру
Фото: Сергей Федосеев
Последние 70 лет большинство вакцин в мире производились по технологии инактивированного или «убитого» вируса. Таким способом были сделаны вакцины от гриппа, тифа, полиомиелита и других болезней, распространение которых в целом удалось снизить в 20 веке благодаря массовой вакцинации. «КовиВак» не стал исключением — в центре Чумакова пошли по протоптанной дорожке и сделали вакцину от COVID-19 по уже отработанной годами технологии.
«Убивают» вирус SARS-CoV-2 на производстве вакцины химическим способом. После этого он не способен заразить человека, но должен вызвать в организме иммунный ответ. Как уверяют разработчики «КовиВак», во время производства вакцину многократно проверяют на остаточную инфекционность. Только после всех проверок она поступает в больницы.
После использования вакцины упаковку от нее сохраняют и учитывают
Вакцина КовиВак
Вакцина «КовиВак» защищает от инфекций:
Похожие вакцины (аналоги КовиВак):
| Вакцина | Цена |
|---|---|
| Спутник V «НИЦЭМ им. Н. Ф. Гамалеи» Минздрава России | 1500 ₽ |
| Спутник Лайт «НИЦЭМ им. Н. Ф. Гамалеи» Минздрава России | 2500 ₽ |
Вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная
Торговое наименование
КовиВак (Вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная)
Лекарственная форма
Суспензия для внутримышечного введения
Состав на 1 дозу (0,5 мл)
| Наименование компонента | Количество |
|---|---|
| Действующее вещество: | |
| Антиген инактивированного коронавируса SARS-CoV-2* | не менее 3 мкг** |
| Вспомогательные вещества: | |
| Алюминия гидроксид | 0,3-0,5 мг |
| Буферный раствор (фосфатный) (динатрия фосфат дигидрат, натрия дигидрофосфата дигидрат, натрия хлорид, вода для инъекций) | до 0,5 мл |
* получен путем репродукции в перевиваемой культуре клеток линии Vero
** является величиной расчетной
Не содержит антибиотиков и консервантов.
Описание
Гомогенная суспензия белого цвета, при отстаивании разделяющаяся на бесцветную прозрачную жидкость и рыхлый осадок белого цвета.
Характеристика
Вакцина представляет собой очищенную концентрированную суспензию коронавируса SARS-CoV-2 штамм «AYDAR-1», полученного путем репродукции в перевиваемой культуре клеток линии Vero, инактивированного бета-пропиолактоном.
Фармакотерапевтическая группа
Код ATX:
Фармакологические свойства
Вакцина стимулирует выработку иммунитета в отношении коронавирусной инфекции, вызываемой коронавирусом SARS-CoV-2. Защитный титр антител в настоящее время неизвестен. Продолжительность иммунитета неизвестна. Клинические исследования по изучению протективной эффективности не проводились.
Показания к применению
Профилактика новой коронавирусной инфекции (COVID-19) у взрослых в возрасте 18-60 лет.
Противопоказания
С осторожностью
При хронических заболеваниях печени и почек, выраженных нарушениях нейроэндокринной системы, тяжёлых заболеваниях системы кроветворения, заболеваниях ЦНС (эпилепсии, инсультах и др.), сердечно-сосудистой системы (ИБС, миокардитах, эндокардитах, перикардитах), бронхолегочной системы (бронхиальной астме, ХОБЛ, фиброзирующих альвеолитах и др.), желудочно-кишечного тракта (при синдроме мальабсорбции и т.п), иммунной системы (при аутоиммунных и аллергических заболеваниях). Лечащий врач должен оценивать соотношение польза-риск вакцинации в каждом конкретном случае.
Применение при беременности и в период грудного вскармливания
Препарат противопоказан при беременности и в период грудного вскармливания, так как его эффективность и безопасность в этот период не изучались.
Способ применения и дозы
Прививки осуществляют при строгом соблюдении правил асептики и антисептики Вакцина предназначена только для внутримышечного введения. Вакцину вводят в дельтовидную мышцу (верхнюю треть наружной поверхности плеча) двукратно с интервалом 2 недели в дозе 0,5 мл.
Строго запрещено внутривенное введение препарата.
Ампула с вакциной не требует выдерживания при комнатной температуре. Перед инъекцией содержимое ампулы встряхивают, прививку проводят сразу после набора в шприц прививочной дозы.
Не пригоден к применению препарат в ампулах с нарушенной целостностью и маркировкой, при изменении физических свойств (интенсивное окрашивание, наличие механических включений), при истекшем сроке годности, неправильном хранении. Хранение вскрытой ампулы не допускается.
Информация для медицинских работников, выполняющих вакцинацию лекарственным препаратом: данный лекарственный препарат зарегистрирован по особой процедуре регистрации, в связи с чем необходимо уведомлять Федеральную службу по надзору в сфере здравоохранения о каждом факте применения лекарственного препарата путем внесения информации в соответствующий раздел информационной системы ЕГИСЗ.
Отсутствуют доступные данные по взаимозаменяемости вакцины КовиВак (Вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная) с другими вакцинами для профилактики COVID-19 для завершения курса вакцинации. Лица, получившие одну дозу вакцины КовиВак (Вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная), должны получить вторую дозу этой же вакцины для завершения курса вакцинации.
Побочное действие
В клинических исследованиях вакцины КовиВак и других инактивированных вакцин для профилактики коронавирусной инфекции наиболее частыми были местные реакции: боль (менее 15% от числа вакцинаций) и уплотнение в месте инъекции (до 1%), и общие реакции: головная боль (до 2 % вакцинируемых) и кратковременная гипертермия (до 1 %). Чаще выявлялись реакции легкой степени тяжести. Тяжелых местных и системных реакций на вакцинацию не было.
Побочные реакции могут появиться в 1-3 сутки после инъекции. Продолжительность реакций обычно не превышает 3-х суток. Не исключено также развитие аллергических реакций, синкопальных состояний (реакция на процедуру введения препарата) и увеличение лимфоузлов. Не исключено присоединение острых (например, ОРВИ и т.п.) или обострение хронических инфекционных заболеваний из-за временного напряжения иммунитета на фоне вакцинации. Литературные данные о выявленных нежелательных реакциях при применении инактивированных вакцин для профилактики новой коронавирусной инфекции свидетельствуют о хорошем профиле безопасности.
Указанные ниже побочные эффекты по данным клинического исследования приведены в соответствии с частотой их возникновения: очень часто (≥1/10), часто ( Общие реакции и реакции в месте введения:
Очень часто: боль в месте инъекции;
Часто: уплотнение в месте инъекции;
Нечасто: повышение температуры тела.
Нарушения со стороны нервной системы:
Часто: головная боль.
Передозировка
Потенциальный риск передозировки не изучен. Применение лекарственного препарата допускается квалифицированным медицинским персоналом в условиях лечебно-профилактических учреждений, риск передозировки крайне низок.
Взаимодействие с другими лекарственными средствами
Ввиду отсутствия данных исследований совместимости, вакцину КовиВак (Вакцина коронавирусная инактивированная цельновирионная концентрированная очищенная) нельзя смешивать с другими вакцинами или иными лекарственными средствами в одном шприце.
Особые указания
Инактивированные вакцины не противопоказаны пациентам с иммуносупрессивным или иммунодефицитным состоянием. Клинические данные применения лекарственного препарата у данной категории пациентов отсутствуют.
У пациентов, получающих иммуносупрессивную терапию, и пациентов с иммунодефицитом может не развиться достаточный иммунный ответ. Поэтому прием препаратов, угнетающих функцию иммунной системы, противопоказан как минимум 1 месяц до и после вакцинации из-за риска снижения иммуногенности.
Места, где проводится вакцинация, должны быть оснащены средствами противошоковой терапии на случай возникновения анафилаксии или другой тяжелой реакции гиперчувствительности после введения вакцины в соответствии с Приказом Министерства здравоохранения РФ от 20 декабря 2012 г. N 1079н «Об утверждении стандарта скорой медицинской помощи при анафилактическом шоке.
С целью выявления противопоказаний в день проведения вакцинации пациент должен быть осмотрен врачом: обязательным является опрос, общий осмотр и измерение температуры тела; в случае если температура тела превышает 37 °С, вакцинацию не проводят.
Вакцинированный должен находиться под медицинским наблюдением не менее 30 мин после вакцинации.
Проведенную прививку регистрируют в установленных учетных формах с указанием наименования препарата, даты прививки, дозы, номера серии, реакции на прививку.
Подобно остальным вакцинам, защитный иммунный ответ может возникать не у всех вакцинируемых лиц.
Влияние на способность управлять транспортными средствами, механизмами
Исследования по изучению влияния вакцины на способность управлять транспортными средствами и потенциально опасными механизмами не проводились.
Форма выпуска
Суспензия для внутримышечного введения, 0,5 мл/доза.
По 1 дозе (0,5 мл) вакцины в ампуле объемом 1 мл, из стекла 1-ro гидролитического класса.
По 10 ампул вместе с инструкцией по применению и ножом ампульным, при необходимости, в пачке из картона коробочного.
Условия хранения
Хранить при температуре от 2 до 8 °С включительно. Замораживание не допускается.
Хранить в недоступном для детей месте.
Условия транспортирования
В соответствии с СП 3.3.2.3332-16 при температуре от 2 до 8 °С включительно. Замораживание не допускается.
Срок годности
6 месяцев
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
Для лечебно-профилактических учреждений.
Производитель
ФГБНУ «ФНЦИРИП им. М.П. Чумакова РАН», Россия, г. Москва, поселение Московский, посёлок Института полиомиелита.
Владелец регистрационного удостоверения/Организация, принимающая претензии потребителя:
ФГБНУ «ФНЦИРИП им. М.П. Чумакова РАН», Россия
108819, город Москва, поселение Московский, посёлок Института полиомиелита, домовладение 8, корп. 1.
Просьба, сведения о рекламации на качество препарата направлять в адрес ФГБНУ «ФНЦИРИП им. М.П. Чумакова РАН» (e-mail: sue_polio@chumakovs.su), о случаях повышенной реактогенности или развития поствакцинальных осложнений (ПППИ) направлять в службу фармаконадзора ФГБНУ «ФНЦИРИП им. М.П. Чумакова РАН» (е-mail: pv@chumakovs.su) и в Федеральную службу по надзору в сфере здравоохранения (в базу АИС Росздравнадзор extemal.roszdravnadzor.ru или e-mail: info@roszdravnadzor.gov.ru).
Узнать наличие вакцины КовиВак и записаться на прививку можно по телефонам центра:
Если хотите пригласить определённого специалиста, оставьте заявку и мы вам перезвоним!
А еще мы отвечаем на интересующие вас вопросы в специальном разделе! Чаще всего это вопросы индивидуального характера в отношении вакцинации, иммунитета и тому подобного.