когда можно делать операцию после химии
Химиотерапия: необходимость и целесообразность. 5 вопросов онкологу
Есть надежда, что не когда-нибудь, а в ближайшее время эффективность лечения одного из самых опасных заболеваний на земле, станет гораздо выше.
1. Химиотерапия при онкологии
Какой метод лечения рака считается основным? И к какому врачу нужно идти больному в первую очередь: к хирургу, онкологу, химиотерапевту?
Чаще всего люди, узнавшие о своем онкологическом диагнозе, бегут к хирургу, рассчитывая, что тот отрежет пораженный опухолью орган и одним махом избавит от бед. Но ведь рак — не хирургическое, а системное заболевание, которое касается не только отдельного органа, а всего организма. Хирург, даже если он не раз оперировал таких больных – лишь один из участников лечения.
Для борьбы с раком есть три равнозначных метода: хирургия, лекарственная и лучевая терапия. Иногда нужны все три, иногда достаточно лишь двух, или даже одного. В идеале вопрос тактики лечения должен решаться коллегиально: хирургом, онкологом и радиологом (специалистом по лучевой терапии).
2. Эффективность химиотерапии
Почему некоторым людям при одном и том же виде рака (и даже одинаковой стадии) лечение помогает, а другим – нет? Ведь химиотерапия, как известно, проводится по специальным протоколам, единым во всем мире.
Да, протоколы одни и те же, но лечение — индивидуальное. Ведь даже рак даже одного органа – это не одна болезнь, а много разных – в зависимости от биологического подтипа опухоли, генетических мутаций. И лечатся они по-разному. Кроме того, важен выбор не только лекарства, но и его дозировки (зависит от веса и роста, состояния здоровья и прочих особенностей больного).
Есть болезни, которые встречаются очень часто (рак молочной железы, например), а есть редкие виды онкологии. Если с первыми можно успешно лечиться у любого онколога, то со вторыми лучше искать врача, который именно на этой теме специализируется.
3. Лекарственная терапия при онкологии
Что нового в последнее время появилось в лекарственном лечении рака? И улучшилась ли переносимость химиотерапии?
Современная «химия» сильно отличается от той, которой она была всего пару десятилетий назад. Поддерживающая, сопроводительная терапия помогает улучшить переносимость этого лечения и избавиться от большинства побочных явлений. К тому же наука не стоит на месте. Например, сегодня активно развивается иммунотерапия, обещающая сделать лечение рака не только более эффективным, но и менее токсичным. Появились новые цитостатики. – лекарства, поднимающие на борьбу с опухолью собственную иммунную систему человека. Например, в лечении меланомы в мире сегодня применяют онколитические вирусы, благодаря которым удалось значительно продлить жизнь людям с этим одним из самых агрессивных видов рака. Введенные в виде инъекций в опухоль, они уничтожают ее.
4. Когда химиотерапия не нужна
Тетя недавно перенесла операцию по поводу рака молочной железы. «Химию» ей не назначили, сказали просто регулярно проходить обследование. Разве так правильно?
Иногда с раком удается справиться и без химиотерапии (правда, таких ситуаций немного). А некоторым больным такое лечение просто не показано. Например, при определенных видах рака химия может быть нецелесообразна у пациентов очень пожилого возраста (ведь с годами деление клеток замедляется, поэтому у стариков опухоли растут медленнее).
От лечения отказываются и тогда, когда лекарство имеет высокий профиль токсичности, а общее состояние пациента – крайне слабое, или есть большой «букет» сопутствующих заболеваний. В таких случаях вред химиотерапии перевешивает пользу.
Иногда бывает лучше сразу перейти к паллиативному лечению, направленному не на исцеление, а на облегчение симптомов и поддержание качества жизни.
5. Когда эффективнее делать «химию»: до или после операции?
Необходимость и целесообразность проведения «химии», а также выбор момента, когда ее назначать, зависит от нескольких моментов. Главные из них – это размер опухоли, ее распространенность и биологическая характеристика, которая определяется с помощью гистологического, иммуногистохимического, а иногда и молекулярного анализа. Последний момент особенно важен, ведь иногда большой рак с метастазами менее опасен, чем маленькая, но агрессивная опухоль.
В большинстве случаев химиотерапию назначают после операции – чтобы уничтожить раковые клетки и микрометастазы, которые могли остаться незамеченными. Но «химию» делают и до операции. Или даже вместо нее. А иногда и до, и после. При метастатическом раке такое лечение зачастую проводится пожизненно.
Предоперационная «химия» помогает уменьшить размеры опухоли, и иногда настолько, что вместо большой операции можно провести вмешательство гораздо меньшего объема. Например, при раке молочной железы химиотерапия, сделанная до операции, в некоторых случаях может позволить даже сохранить пациентке грудь. Есть данные, что некоторые виды рака уже сегодня можно победить только с помощью «химии».
Онлайн консультации врачей
в мобильном приложении Доктис
Дежурный терапевт и педиатр консультируют бесплатно
Химиотерапия при раке: продолжительность лечения и реабилитация
Химиотерапией называется метод лечения рака цитостатиками – сильнодействующими химическими веществами, угнетающими жизнедеятельность злокачественных клеток. Онкологи используют химиопрепараты в комплексной терапии многих видов опухолей. В различных схемах лечения с химиотерапией при раке может комбинироваться лучевая терапия (ЛТ), хирургическая операция, таргетная (целевая) терапия, био-терапия (иммунотерапия), гормонотерапия.
| Город/Телефон | Центр |
|---|---|
| Москва +7 499 450-66-76 | Онкоцентр Медскан |
| Москва +7 499 322-26-14 | Центр София |
| Санкт-Петербург +7 812 501-83-10 | ЛДЦ МИБС |
| Воронеж +7 473 300-34-90 | Межрегиональный онкоцентр |
Химиотерапия до и после операции
Химиотерапевтическое лечение часто сочетается с хирургическим, особенно в тех случаях, когда опухоль обнаружена на более поздних стадиях, а злокачественные клетки высоко чувствительны к воздействию химиотерапевтических препаратов.
В зависимости от формы, локализации и стадии рака, цитостатики могут назначаться:
Делают ли химиотерапию после операции, если опухоль обнаружена на ранней стадии и полностью удалена? В каждом конкретном случае ответ на этот вопрос может дать только лечащий врач. Для этого он анализирует данные биопсии тканей из послеоперационной зоны, степень злокачественности раковых клеток, состояние иммунитета, другие факторы и решает, нужна ли химиотерапия после операции.
Химиотерапия и лучевая терапия
Этим методы часто назначаются в комплексе при лечении агрессивных форм рака. Грамотно комбинируя современные эффективные и безопасные методики лучевого и химиотерапевтического лечения, врачи способны вывести больного в стойкую ремиссию. Эта возможность особенно ценна, если провести операцию сложно или невозможно.
На поздних стадиях рака онкологи обычно используют все три основных метода лечения: лучевой, химиотерапевтический и хирургический. Если у больного диагностируется рак 4 стадии, при такой онкологии химиотерапия часто выступает основным, а нередко – и единственным эффективным способом лечения.
Продолжительность курса химиотерапии
Как правило, химиотерапевтическое лечение разбивается на несколько этапов (циклов). От их продолжительности и количества зависит, сколько дней длится курс химиотерапии. Например, цикл химиотерапии при раке может продолжаться 4 недели: в течение первой недели больной получает химиопрепараты, а в течении 3-х последующих недель его организм отдыхает от их действия. Затем проводится диагностическое обследование и принимается решение о продолжении курса, если для этого имеется необходимость.
Учитывая токсичность цитостатиков и возможные осложнения, схема терапии может корректироваться в процессе лечения.
Действие цитостатиков на раковые клетки и их влияние на здоровье человека
Клетки злокачественных опухолей растут и развиваются гораздо быстрее, чем абсолютное большинство нормальных клеток. Поэтому они активнее накапливают химиопрепараты и погибают.
При назначении больших доз цитостатиков, продолжительном лечении, ослабленном иммунитете и/или изначальном нарушении функции различных органов могут развиваться более серьезные нарушения и, как следствие, появляется необходимость их лечения на этапе восстановления.
Реабилитация и восстановление
Реабилитация после химиотерапии в условиях клиники требуется не всегда. Для уменьшения любых нежелательных последствий химиотерапии при онкологии врач тщательно оценивает общее состояние здоровья пациента и особенности рака. Это позволяет подобрать оптимальную схему лечения, сведя к минимуму риск осложнений.
Если побочные эффекты все-таки появились, некоторые из них могут пройти самостоятельно. В том числе, рост и восстановление волос после химиотерапии обычно не требуют вмешательства врача.
В других случаях может понадобиться соблюдение определенного режима и/или медикаментозное лечение. Так, например, поднять лейкоциты в крови после химиотерапии при их незначительном снижении и работающем иммунитете способно правильное питание. В рацион необходимо добавить гречневую и овсяную кашу, морепродукты и кисломолочные продукты, мед, цикорий, орехи, бобовые, пророщенные злаки. Полезно пить отвары из неочищенного ячменя, легкое красное вино.
Если проблема серьезнее, для повышения лейкоцитов назначаются препараты, нормализующие кроветворение. К ним относятся мягко действующие имунофан и полиоксидоний, а также более сильный иммуностимулятор – лейкоген.
Наиболее выраженным эффектом обладают мощные препараты из группы колониестимулирующих факторов – нейпоген (филграстим), граноцит и их аналоги. Эти лекарственные средства способствуют выработке лейкоцитов, ускоряют их созревание и повышают продолжительность жизни, однако такое лечение не всем показано и может сопровождаться осложнениями. Поэтому медикаментозная коррекция количества лейкоцитов в крови требует постоянного контроля со стороны гематолога и онколога.
Многие исследовательские центры находятся в постоянном поиске возможностей увеличения дозы химиопрепарата с одновременной минимизацией его системной токсичности.
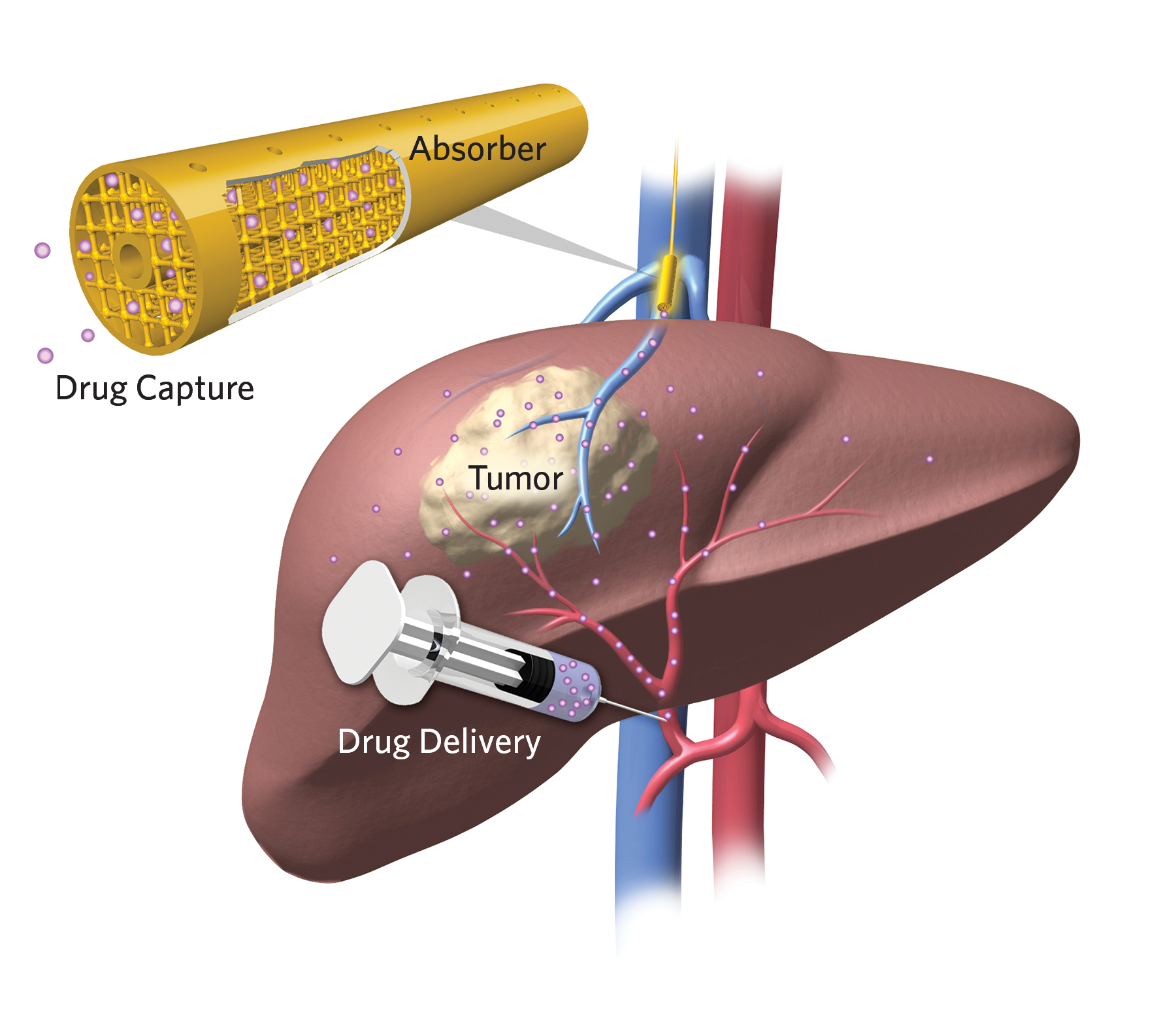
В Калифорнийском университете в Сан-Франциско разрабатывают технологию внутривенного захвата лекарств на выходе из обработанного органа. Для этого используют губчатую трубочку, пропитанную материалом, связывающим лекарства. В доклинических испытаниях 64% химиопрепарата поглощалось фильтром, локализованным в области вены, собирающей кровь от пораженного органа.
Эта технология позволит значительно уменьшить побочные эффекты цитостатиков и использовать более высокие дозы для терапии, токсичные при обычном применении.
По словам исследователей из Калифорнийского университета в Беркли, фильтр был создан на основе поглотителей, используемых для удаления из топлива нежелательных примесей, и работает как стенты в сердечно-сосудистой хирургии.
«Буквально, мы взяли концепцию переработки нефти и применили ее к химиотерапии», — профессор Н. Балсара, один из авторов исследования, — Хирурги помещают губку в вену как стент, и оставляют ее на время химиотерапии»
Подробная информация о химиотерапевтическом лечении при разных видах рака:
Бесплатная онлайн консультация
Чтобы сразу получить подробную консультацию ведущих онкологов, загрузите имеющиеся у вас документы: выписки, результаты ПЭТ КТ, МРТ, КТ, онкомаркеры.
Лечение после химиотерапии
Химиотерапия – один из безоперационных способов борьбы с раком. Лечение основано на введении в организм больного препаратов, которые содержат токсины и яды, сдерживающие или полностью прекращающие рост злокачественной опухоли. Химиотерапия наносит громадный урон человеческому организму. В результате воздействия ядов и токсинов повреждаются и гибнут не только атипичные клетки, но и здоровые, поражается печень, почки и другие системы. Поэтому после химиотерапии человеку необходимо лечение – комплексное, профессиональное, которое поможет справиться с побочными эффектами, пойти на поправку и полностью восстановиться.
Когда показана химиотерапия?
Решение о медикаментозном лечении онкологии принимает лечащий врач, основываясь на результатах анализов и аппаратных исследований. Как правило, к химиотерапии прибегают в следующих случаях:
Чаще всего медикаментозная терапия онкологии назначается для профилактики метастазирования ранее удалённых опухолей, а также лечения рака крови (лейкоз, гемобластоз) и других редких видов злокачественных новообразований (хориокарцинома, рабдомиосаркома). Также химиотерапия применяется для подготовки опухоли к операции – чтобы хирург мог её полностью удалить, не оставив ни единой раковой клетки.
Какие препараты химиотерапии для каких опухолей применяются
Это 2 группы средств консервативного лечения рака – цитостатики и цитотоксины. Первые проникают в атипичную клетку, нарушают её ДНК, запуская процесс самоуничтожения. Чаще всего для лечения используются следующие цитостатики: Гидроксимочевина, Фторурацил, Циклофосфан, препараты платины.
Цитотоксины уничтожают клетки – и раковые, и здоровые, вызывая тяжёлые побочные эффекты в организме у больных раком. Среди таких препаратов выделяют несколько групп:
Больше всего побочных эффектов у цитостатиков и цитотоксинов. Поэтому лечение после химиотерапии – неотъемлемая часть процесса избавления от рака. Оно позволяет ускорить восстановление клеток организма, облегчить состояние больного и улучшить качество его жизни.
Побочные эффекты химиотерапии
Рак – тяжёлое заболевание, которое требует от пациента немалых физических и эмоциональных сил для лечения. Побочные эффекты, среди которых не только физиологические, но и психологические страдания, многих выбивают из колеи, заставляя замкнуться, отгородиться от внешнего мира. Это часто приводит к ухудшению общего состояния больных раком.
Наиболее частые побочные эффекты при лечении химиотерапией:
Это лишь небольшая часть побочных эффектов при лечении рака химиопрепаратами. Реакция организма зависит не только от его индивидуальности, но и от применяемых средств. Если больному раком назначают для лечения лекарства таргетной терапии, то проблем с ЖКТ скорее всего не будет. У таких пациентов почти не бывает тошноты, рвоты, изжоги, поносов и запоров. Также большую роль играет предподготовка к лечению, которая позволяет провести реабилитацию большинства хронических заболеваний. Это помогает избежать их обострения после химиотерапии и быстрее восстановиться.
Лечение онкобольных после медикаментозной терапии рака
Применение лекарств для купирования злокачественного процесса имеет множество положительных моментов, за исключением одного – побочных эффектов. Однако с ними можно справиться, если своевременно начать лечение после химиотерапии рака.
Его назначает лечащий врач, опираясь на результаты последних анализов, аппаратных исследований и жалобы пациента. Лечение включает в себя:
Диета в пост лечении рака
Одна из распространённых реакций организма на терапию препаратами, содержащими яды и токсины – тошнота и потеря аппетита. Отказываться от еды нельзя, потому что она даёт силы для восстановления, однако рацион пересмотреть придётся.
Основные рекомендации по питанию больных раком, которые восстанавливаются после лечения химиотерапией:
Рекомендации по самому рациону касаются не только продуктов, но и приготовления различных блюд:
В день больному раком, который проходит лечение после воздействия химиопрепаратами, нужно выпивать около полутора литров жидкости. По этому вопросу рекомендуется проконсультироваться с врачом. Если наблюдается скопление жидкости в брюшине, лёгких или плевральной полости, её количество ограничивают.
Иммуномодуляторы в пост лечении рака
Химиотерапия для организма человека представляет сильнейший стресс. Больше всего повреждается костный мозг, отвечающий за кровь. После лечения её показатели значительно ухудшаются, показывая нехватку основных компонентов – лейкоцитов, эритроцитов и тромбоцитов, из-за чего возникают лейкопения, эритропения, тромбоцитопения.
Нехватка белых кровяных телец в организме сказывается на иммунитете – он становится настолько слабым, что больной может подхватить любую инфекцию или вирус, к которым ранее был невосприимчив. Для коррекции состояния больных раком лечение после химиотерапии всегда включает препараты-иммуномодуляторы, которые стимулируют гемопоэз (процесс кроветворения в костном мозге):
Иммуномодулирующие препараты применяются для улучшения качества жизни пациентов, больных раком. Их эффективность доказана более чем 30-летней практикой применения у онкологических больных во время химиотерапии и в период восстановления.
Симптоматическое лечение
Лечение расстройств ЖКТ
Первое, что делает врач – устанавливает причину состояния. Тошнота и рвота возникают не только от отравления организма больного раком при лечении токсическими противоопухолевыми препаратами. Часто это происходит в результате кишечной непроходимости – механической или динамической (отёк головного мозга, гиперкальциемия). Если ничего серьёзного не обнаружено, больному раком для лечения прописывают Церукал или Дексаметазон, если они действуют слабо, могут назначаться Зофран, Навобан, Осетрон.
Запор – один из побочных эффектов химиотерапии у особо тяжёлых больных. Здесь рекомендации врача исключительно индивидуальны. Если не стоит вопрос об оперативном лечении запора, проводят поэтапную терапию:
Диарея возникает либо как функциональное нарушение, либо как психоневрологическое осложнение после химиотерапии рака. Лечение включает в себя:
Если анализы выявляют инфекционную природу диареи, для лечения состояния назначаются антибиотики.
Печень и почки
Оба органа участвуют в фильтрации, а потому сильнее остальных поражаются при лечении от рака. Для восстановления печени сначала нужно её очистить от скопившихся в ней вредных веществ. Для этой цели применяется Легалон – препарат на основе семян расторопши. После очищения основная задача – восстановить повреждённые химиотерапией клетки печени, чтобы орган снова заработал корректно и начал выполнять свою прямую функцию – очищать кровь от вредных веществ. Для лечения используют БАДы – Эссенциале Форте, Карсил, Флор Эссенс.
С почками несколько сложнее. Агрессивное воздействие токсических/ядовитых препаратов может вызвать мочекислую нефропатию, почечную недостаточность. Для восстановления правильной работы почек применяют:
Если диагностируются воспалительные заболевания почек и мочевыводящих путей, для лечения назначаются антибактериальные препараты – Нитроксолин, Фурадонин.
Кровь
При лечении рака сильнодействующими токсичными препаратами в крови наблюдается сильная нехватка компонентов. Чтобы повысить уровень лейкоцитов, назначаются витаминные комплексы, содержащие витамины группы B, в частности B9 и 12.
Аскорбиновая и фолиевая (витамин B9) кислоты, кальций + витамин D3, магний и цинк ускорят выработку тромбоцитов. Эритроциты восстанавливаются самостоятельно. Повысить гемоглобин можно с помощью витаминов B12, B9, препаратов железа.
Психологическая помощь
Для пациентов, больных раком, свойственны стрессы и депрессия, которые загоняют человека в состояние безысходности и апатии. Это прямым образом сказывается на процессе лечения и выздоровления. Помощь психотерапевта в такой ситуации необходима. Важно найти своего врача, которому можно доверять и рассказывать о своих страхах и фобиях. Это поможет больному раком вернуться к полноценной жизни в социуме.
После каждого курса химиотерапии пациент нуждается в комплексном лечении. Выполняя все рекомендации лечащего врача, больной быстрее восстанавливается, что позволяет ему не выпадать надолго из нормальной жизни.
Что вам необходимо сделать
2. Нашим пациентам мы предлагаем курсы реабилитации:
3. Если вам понравилась статья оставьте комментарии ниже.
Когда можно делать операцию после химии
В настоящее время именно мультимодальный подход – неоадъювантное химиолучевое лечение с последующей радикальной операцией – принят большинством ученых как стандарт лечения местнораспространенных опухолей таких локализаций, как рак пищевода и рак прямой кишки, по причине лучших показателей частоты полной регрессии, R0 резекций и локального контроля, что коррелирует с общей выживаемостью. Неоднократно показано, что повышение частоты полной регрессии улучшает отдаленные результаты лечения и даже способно отражать картину возможного будущего рецидива заболевания: у пациентов с достигнутым полным ответом на проведенное лечение впоследствии чаще наблюдается отдаленное метастазирование, нежели локальный рецидив. Однако как для оценки клинического ответа на проведенное химиолучевое лечение, так и для реализации максимально возможного патоморфологического ответа требуется время. Недаром, согласно методологии проведения научных клинических исследований с включением лучевой терапии, оценивать степень регрессии опухоли после облучения либо химиолучевого лечения желательно не ранее чем через 2 месяца. Ни рак пищевода, ни рак прямой кишки не относятся к опухолям с очень высокой радиочувствительностью, и для реализации лечебного эффекта требуется определенный промежуток времени.
За последние полтора-два десятилетия химиолучевое лечение рака пищевода и прямой кишки прочно вошло в повседневную практику в качестве компонента тримодального лечения. Каким должен быть оптимальный интервал между неоадъювантным этапом и операцией – в этом вопросе единого мнения среди исследователей не наблюдается. Более того, в последнее время было представлено несколько солидных исследований с выводами, порой весьма отличающимися друг от друга.
Традиционно принято выдерживать интервал в 6-8 недель между неоадъювантным этапом лечения и операцией. На практике же данные временные промежутки варьируют в гораздо больших пределах – от 2 недель до 3 месяцев.
В отношении рака пищевода по данному вопросу опубликовано несколько статей за последние 5-6 лет, являющих собой как ретроспективные анализы, проспективные работы, либо представляющих отдельные аспекты в рамках крупных рандомизированных исследований, в частности, CROSS trial 2015 года. Так, в своем ретроспективном анализе 2010 года итальянские авторы Ruol et al. [1], разделив 129 больных на две группы (А – операция в сроки до 45 дней после неоадъювантного лечения и В – позже 45 дней), продемонстрировали улучшение показателей общей 5-летней выживаемости в группе В (42,6% против 33,1%), особенно если удавалось достигнуть R0 резекции (56,3% против 37,8% в группе А), хотя без статистической достоверности. При этом риск локального рецидива был достоверно ниже в группе отсроченной операции (25% против 48,3%, p=0,02).
Американские авторы в проспективном исследовании сравнивали прежде всего частоту возникновения периоперационных осложнений, а потом уже патоморфологический ответ и общую выживаемость [2]. Каких либо значительных отличий в плане продолжительности операции, кровопотери, несостоятельности анастомоза и числа периоперационных осложнений в целом между двумя группами больных, оперированных в пределах 8 недель после неоадъюванта или позже, отмечено не было. Более того, процент патоморфологического ответа и выживаемость оказались также схожими, что позволило авторам сделать вывод о безопасной возможности отсрочить операцию и свыше 8 недель, если пациент еще не полностью восстановился после химиолучевого лечения.
Промежуточный анализ авторов рандомизированного исследования CROSS [3] также продемонстрировал, что «передышка» в 7-8 недель несет статистически достоверное (p=0,0004) увеличение процента полного патоморфологического ответа, хотя и с небольшим ростом риска послеоперационных осложнений. Но, в любом случае, если есть необходимость пролонгировать период ожидания свыше 8 недель по состоянию больного – эта стратегия может быть вполне приемлема.
Однако крупный ретроспективный анализ 2016 года от бельгийских авторов, основанный на результатах лечения 4284 больных аденокарциномой пищевода (данные были взяты из Национального ракового регистра), получивших неоадъювантное химиолучевое лечение и впоследствии прооперированных за период с 2003 по 2011 гг., явился своеобразной ложкой дёгтя для приверженцев тактики отсроченной операции [4]. Разделив все случаи на 4 группы по интервалам до операции (до 5 недель, от 5 до 7 недель, от 7 до 9 недель и свыше 9 недель) и проанализировав результаты средней и 5-летней выживаемости, авторы продемонстрировали ухудшение показателей по мере увеличения дооперационного промежутка времени. Так, медиана выживаемости составила 35,5, 35,2, 34,1 и 28,2 месяца соответственно, а 5-летняя выживаемость – 35,0%, 32,3%, 30,9% и 29,1% соответственно. При этом процент полных патоморфологических регрессий, действительно, возрастал в случае более длительного периода ожидания операции, но, по мнению авторов, это не влияло на отдаленные результаты лечения.
По данной проблеме существует и мета-анализ на основе результатов 5 исследований с общим количеством больных плоскоклеточным раком и аденокарциномой пищевода, составившим 1016 человек [5]. В нем временным «водоразделом» стал промежуток в 7-8 недель после проведенного неоадъювантного химиолучевого лечения. Авторы продемонстрировали, что процент полных патоморфологических ответов, послеоперационных осложнений и частоты несостоятельности анастомозов был примерно одинаков в обеих группах, но при этом показатели 2-летней выживаемости оказались достоверно хуже в группе более долгого интервала (p=0,01). Основной вывод, следующий из вышесказанного: необходимо больше проспективных исследований, поскольку на данный момент делать определенные выводы рано. Видимо, в отношении рака пищевода научный мир пока остается на прежних позициях – оперативное лечение желательно выполнять в сроки 4-8 недель: не позднее, дабы не ухудшить показатели общей выживаемости, но и не ранее во избежание послеоперационных осложнений и смертности пациентов, не восстановившихся после неоадъювантного лечения.
В случае рака прямой кишки стремление достичь большего процента полных патоморфологических регрессий после неоадъювантного лечения (что ассоциировано с лучшими отдаленными результатами) привело к пролонгированию интервала вплоть до 11-12 недель. По данной проблеме существует немало как ретроспективных, так и проспективных исследований. Так, Petrelli и соавторы на основании анализа результатов 13 работ, включающих 3584 пациентов, отметили, что удлинение интервала свыше традиционных 6-8 недель достоверно увеличивает частоту pCR с 13,7% до 19,5%, при этом показатели общей и безрецидивной выживаемости, а также частота R0 резекций и сфинктеросохраняющих операций были примерно одинаковы в обеих группах [6].
Результаты 15 ретроспективных исследований (с общим количеством больных 4431) постарались обобщить в своем мета-анализе 2016 года Wang с соавторами [7], подтвердив, что частота отмеченных полных патоморфологических ответов действительно значительно выше после 7-8 недель, нежели после оперативных вмешательств, проведенных в более короткие сроки (p






