какой пробиотик можно беременным после антибиотика
Пробиотики для кишечника: список препаратов
Ребенок появляется на свет со стерильным кишечником, но уже к году состав микрофлоры совпадает со взрослым человеком. На протяжении жизни под влиянием питания, болезней и других факторов баланс микроорганизмов в пищеварительном тракте изменяется, но постепенно восстанавливается до нормальных концентраций. Иногда этот процесс затягивается. Тогда врач может рекомендовать пребиотики и пробиотики для кишечника.
Виды пробиотиков
Для восстановления кишечника применяют два типа лечебных средств. Пробиотики – это препараты, которые содержат полезные бактерии в высушенном или растворенном виде. Чаще всего это микроорганизмы из рода Lactobacillus и Bifidobacterium, которые в норме доминируют в пищеварительном тракте человека.
Пребиотиками называются вещества, необходимые для роста хорошей микрофлоры. В некоторых случаях без них можно обойтись, но после тяжелых болезней, лечения антибиотиками или отравления они ускорят восстановление за счет создания благоприятной среды для бактерий.
В пищеварительном тракте здорового взрослого человека обитает несколько десятков видов бактерий, но преобладают два типа микробов: бифидобактерии и лактобактерии. Другие находятся в меньшинстве. Поэтому выделяют следующие виды пробиотиков в зависимости от состава:
Восстанавливать нормальную микрофлору можно разными формами препаратов. Пробиотики выпускают в сухой форме, из которой перед применением самостоятельно готовят суспензию. Существуют готовые жидкие формы лекарства, которые удобно давать маленькому ребенку. Некоторые средства производят в капсулах в желатиновой оболочке. Она не повреждается в желудке и растворяется только в кишечнике. Это защищает бактерии от действия соляной кислоты.
Создание препаратов для решения проблем с пищеварением проходило в несколько этапов. Поэтому фармацевты выделяют несколько поколений пробиотиков:
Какой препарат подойдет в конкретном случае, должен решать врач с учетом состояния пациента, его возраста. Для взрослых требуется большая дозировка и кратность приема пробиотиков.
ТОП-10 лучших пробиотиков
В аптеках продается большое количество пробиотиков, из которых тяжело выбрать нужный препарат. Правильное решение – обратиться к врачу-гастроэнтерологу или терапевту, чтобы назначили лекарственное средство с хорошим эффектом.
Чтобы решить, какой из них лучше, можно ориентироваться на список ТОП-10:
Советы по выбору
Какой из перечисленных пробиотиков поможет справиться с проблемами пищеварения, зависит от заболевания. Если организму необходима помощь после курса лечения антибиотиками, лучше использовать комплексные препараты, где добавлен пребиотик. Он ускорит заселение бактериями слизистой кишечника.
Вне зависимости от названия, для взрослых походят препараты в виде порошка, капсул или раствора. Капли разработаны специально для маленьких детей, которым необходима небольшая доза препарата. Их хорошо смешивать с напитками или молоком матери.
При использовании средств с пробиотическими эффектами, симптомы вздутия живота, урчания, метеоризм могут усилиться из-за процесса брожения. Но это проходит самостоятельно и не требует отмены терапии. Если на фоне приема пробиотиков появилась аллергическая сыпь, лечение прекращают.
Препараты для восстановления микрофлоры кишечника
Относится к группе пребиотиков. Содержит в себе ЛАКТУЛОЗУ (дисахарид, созданный искусственным путем. В процессе разложения лактулозы снижается кислотность содержимого кишечника, повышается давление в просвете кишки и усиливается ее перистальтика. Поэтому при нарушении микрофлоры с нарушением стула (запором), наблюдается значительное улучшение состояния при приеме Дюфалака. Большинство патогенных бактерий живут в слабощелочной или нейтральной среде. Препарат угнетает рост патогенной микрофлоры, за счёт создания кислой среды в кишечнике, а так как лактулоза служит питательным субстратом для бактерий кишечника, нормализуется состав микрофлоры.
Как принимать: Дюфалак выпускается в виде сиропа со сливовым вкусом. Можно принимать как в разбавленном виде, так и неразбавленном. Всю дозу необходимо сразу проглотить.Пребиотическая доза препарата и длительность приема подбираются индивидуально, учитывая частоту стула у пациента, у взрослых 5–10 мл, у детей 2,5–5 мл 1 раз в сутки.
Бифиформ.
Относится к многокомпонентным пробиотикам. Содержит в себе Бифидобактерии и Энтерококки. А сама капсула препарата является одновременно и защитой от расщепления в желудке и питательным субстратом для данных штаммов бактерий. Важно, что препарат, в отличии от многих других препаратов для восстановления микрофлоры не содержит лактозы. Поэтому он актуален для людей с ее непереносимостью. Препарат не только помогает заселить кишечник полезными бактериями, но и стимулирует развитие местного иммунитета. Как принимать: для восстановления и поддержания микрофлоры рекомендуется принимать по 1 капсуле 2-3 раза в день курсом от 2 до 3 недель. Не зависит от приема пищи, что тоже является дополнительным плюсом при применении.
Флорин Форте.
Поликомпонентный пробиотик, который содержит в себе 2 типа штаммов: Бифидобактерии и Лактобактерии. Это единственный в своем роде поликомпонентный пробиотик, в котором микроколонии бактерий сорбированы по специальной технологии на частицы активированного угля. Данная технология позволяет препарату доставить бактерии в кишечник в неизменном виде, а компоненты угля помогают им прикрепиться к кишечной стенке. Штаммы бактерий не являются генно-модифицированными. Выявлена высокая эффективность препарата при нарушениях стула (диареи). При данном симптоме средство действует наиболее эффективно, по сравнению с другими препаратами-пробиотиками по данным последних исследований. Большим достоинством вещества является его безопасность. Его можно давать детям с первых дней жизни (и даже недоношенным детям), а также беременным и кормящим женщинам. Как принимать:Флорин-Форте представлен в форме порошка. Прием желательно производить во время еды, но строгой зависимости нет. Препарат смешивают с жидкой пищей (в идеале с кисломолочным продуктом) или водой. Новорожденным и детям грудного возраста препарат смешивают с грудным молоком. Дозировка зависит от возраста. Взрослым пациентам назначается по 2 пакета 3 раза в сутки, детям по 1 пакету 2-4 раза в сутки. Препарат содержит лактозу.
Линекс.
Является одним из самых известных в группе поликомпонентным пробиотиком. В составе Линекса целых три непатогенные бактерии — Лактобактерии, Бифидобактерии и Молочный Стрептококк. Особо эффективна эта комбинация при нарушении микрофлоры, связанной с приемом антибиотиков, а Энтерококк позволяет нормализовать микрофлору в верхних отделах кишечника, что можно встретить не у все пробиотических препаратов. По данным исследований, именно при диарее, вследствие приема антибиотиков, Линекс показал хорошие результаты. Также препарат положительно влияет на иммунитет, т.к. участвует в синтезе аскорбиновой кислоты и образует вещества с антибактериальными свойствами, что может помочь при легких формах кишечных инфекций. Большим плюсом Линекса является устойчивость микроорганизмов, входящих в состав препарата к антибиотикам. Именно поэтому препарат можно принимать параллельно с терапией антибактериальными препаратами. Как принимать: его можно принимать детям, пожилым людям, беременным и кормящим женщинам. Дозировка зависит от формы выпуска. Для взрослых более удобен прием в форме капсул (рекомендованная доза — по 2 капсулы 3 раза в день). Для детей существуют саше с порошком или капли, которые можно добавлять в молоко, сок и другие негорячие напитки. Запивать капсулы также не рекомендуется горячими напитками или алкоголем. Если при приеме препарата наблюдается повышение температуры или ухудшение общего состояния требуется дополнительное наблюдение врача.
Пробифор.
Пробиотик, содержащий один штамм бактерий — Бифидобактерии. Также в составе — активированный уголь. Препарат, используемый не только для поддержания и восстановления микрофлоры, но и для лечения кишечных инфекций неизвестной этиологии, диареи и интоксикации. Содержит лактозу, поэтому противопоказан при ее непереносимости. Является достаточно активным препаратом, которые показывает высокую эффективность в лечении кишечных заболеваний. Как принимать: Пробифор принимают внутрь во время приема пищи, при необходимости — независимо от приема пищи. Выпускается в форме капсул и порошка. Капсулы можно принимать только детям от 5 лет и взрослым, порошок всем возрастным группам.
Бифидумбактерин.
Однокомпонентный пробиотик, содержащий штамм Бифидобактерий. Имеет много лекарственных форм (капсулы, суспензия, суппозитории, порошок). У данного препарата очень мягкое воздействие на микрофлору, поэтому четкой схемы приема нет. Можно применять как детям, так и беременным женщинам. Одним из плюсов препарата является его ценовая доступность.
Лактобактерин плюс.
Пробиотик, содержащий один штамм бактерий — Лактобактерии. Помимо нормализации микрофлоры, имеет свойство повышения иммунной защиты организма. При аллергических проявлениях также оказывает высокую эффективность. Форма выпуска: жидкий концентрат. Такая форма более удобна чем порошковая, так как нет необходимости разведения. Рекомендуется сочетать препарат с приемом витаминов, так как это усиливает его действие. Ввиду высокой устойчивости к антибактериальным препаратам, также допускается совместный прием при антибактериальной терапии. Как принимать: важно, что Лактобактерин разрешен для приема детям с первых дней жизни. Принимать его нужно не позднее чем за 30 минут до еды, предварительно встряхнув флакон, запивая небольшим количеством воды. Дозировка зависит от возраста, у детей до 12 лет это 1-3 мл в день, у взрослых – 3-5 мл. Также Лактобактерин назначается для поддержания микрофлоры уже после лечения курсами на 1-1,5 месяца.
Полисорб.
Данный препарат не входит в группу про- и пребиотиков. Но он отлично справляется с подготовкой организма к приему препаратов для восстановления кишечной микрофлоры, особенно после приема курсов антибиотиков. Это мощный энтеросорбент. Он обладает всеми важными качествами данной группы препаратов (не обладает токсическими свойствами, не травмирует слизистые оболочки, хорошо удаляется из кишечника, имеет хорошие связывающие свойства, не вызывает нарушения микрофлоры и имеет удобную лекарственную форму). Основное предназначение данного препарата — выведение токсинов из организма. Он очень эффективен при аллергических проявлениях нарушения микрофлоры. Улучшает состояние кожи. Также связывает избыток холестерина и других вредных жирных кислот, нейтрализуя их. Как принимать: выпускается в виде порошка, который обязательно нужно растворить в ¼-1/2 стакане воды. Доза препарата зависит от массы тела пациента. Полисорб проходит через желудочно-кишечный тракт и выводится в полностью неизменном состоянии.
Все эти препараты направлены на улучшения состояния нормальной микрофлоры кишечника. При постоянном приеме и соблюдении инструкций, пациент начинает отмечать улучшение уже после 5-7 дней приема. При выборе пробиотика или пребиотика, необходимо учитывать индивидуальную непереносимость некоторых компонентов препарата, возраст и степень выраженности нарушения микрофлоры кишечника. Во всех случаях рекомендуется проконсультироваться с лечащим врачом. При правильном выборе и приеме препаратов, а также сбалансированном питании и ведении здорового образа жизни ваш кишечник скажет вам спасибо!
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ, НЕОБХОДИМО ОЗНАКОМИТЬСЯ С ИНСТРУКЦИЕЙ ИЛИ ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ.
Профилактика дисбактериоза и взаимосвязанных патологий у будущего ребенка и уже рожденного малыша
ПРОБИОТИКИ. БЕРЕМЕННОСТЬ И ПОСТНАТАЛЬНЫЙ ПЕРИОД
1. Возможность пробиотической коррекции нарушений микрофлоры матери для профилактики возможных осложнений у ребенка. Влияние микрофлоры матери на формирование здоровья будущего ребенка
1.1. Введение
Хорошо известно, что формирование микробиоты человека начинается еще в период внутриутробного развития. При этом генная последовательность микроорганизмов, обнаруженных у матери в тканях матки и плаценте, повторяется у новорожденного [1,2]. Хотя ранее считалось, что амниотическая жидкость стерильна, на основании генных методов исследования выявлены некоторые общие признаки бактериального профиля полости рта у матери и амниотической жидкости плода и плацентарных образцов [3]. Установлено, что бактерии присутствуют в амниотической жидкости, меконии, кишечнике у здоровых новорожденных. После рождения, примерно до 3 лет, происходят дифференцировка и формирование уникального состава микросреды кишечника индивидуума, которая практически не меняется в течение всей жизни.
Множество факторов влияет на формирование микробиоты кишечника младенца: в период внутриутробного развития микрофлора матери, состояние ее здоровья, в дальнейшем условия и способы ведения родов, грудное или искусственное вскармливание и т.д. До 80% информации о микробиоте матери передается к плоду. Первые несколько дней после родов микробиота у здоровых младенцев, рожденных естественным путем, содержит большое количество лактобацилл, пропорциональное числу лактобактерий в вагинальной флоре. Между тем доля лактобактерий в кишечнике у младенцев, рожденных кесаревым сечением, быстро истощается; наблюдается задержка колонизации рода Bacteroides, но происходит колонизация факультативными анаэробами, такими как Clostridium species, свойственными для лиц зрелого возраста, но в детском организме приобретает патогенные свойства.
Неблагоприятные факторы внешней среды нарушают у новорожденных заселение бифидобактериями, приводят к длительному персистированию аэробов (протеобактерий), что нарушает формирование иммунной толерантности растущего организма.
У детей с манифестацией атопического дерматита в первые 6 мес жизни уже изначально регистрируется активная колонизация кишечника протеобактериями, аэробными грамотрицательными бактериями, спектр которых практически идентичен таковому у их матерей с патологическим течением беременности, обусловлен также дисбиозом, снижением нормальной колонизации лактобатериями. У аэробных грамотрицательных бактерий кишечного происхождения (цитобактер, клебсиелла, протей, кишечная палочка с измененными свойствами) у матери и младенцев с нарушениями становления кишечной микробиоты выявлена высокая интенсивность продукции гистамина. Этот признак относят к дополнительным, прогностически значимым критериям реализации аллергической настроенности организма ребенка на заболевание [6].
1.2. Роль бактериальных метаболитов в детском возрасте и механизмы биологической активности пробиотиков
В норме в микробном сообществе детей раннего возраста в тонком кишечнике преобладает Lactobacillaceae, в толстой кишке доминируют Prevotellaceae, Lachnospiraceae и Rikenellaceae. Применение пробиотических препаратов может быть рекомендовано для коррекции нарушений микрофлоры матери и профилактики возможных осложнений у ребенка [7].
С учетом процессов метилирования ДНК установлено, что организм особенно уязвим в критические периоды развития, включая внутриутробную и раннюю послеродовую жизнь, которая относится к концепции «первые 1000 дней жизни» [8]. Одна из основных причин может заключаться в том, что это период, когда делящимся клеткам требуется относительно высокий уровень метильных доноров для метилирования позиций CpG в новообразованной цепи ДНК для поддержания установленных образцов метилирования. В отсутствие достаточного количества метильных доноров метиловые метки затем могут быть полностью потеряны [9].
Эпигенетически уязвимые периоды различаются для разных органов. Органы, подобные сердцу, формируются в начале эмбриогенеза, когда воздействие бактериальных метаболитов происходит только косвенно через мать, поэтому могут быть почти инертными по отношению к этим факторам. С другой стороны, органы, которые формируются и дифференцируются в более поздний период, как мозг, или с высокой скоростью деления клеток, как, например, клетки кишечника, могут быть более восприимчивыми к влиянию метаболитов из микробиоты матери.
Представители нормальной микрофлоры кишечника у детей обладают адгезивными свойствами, фиксируясь на эпителии слизистой оболочки кишечника, они образуют пристеночный слой, что обеспечивает колонизационную резистентность организма. Они устойчивы к неблагоприятным внешним воздействиям за счет образования клеточного муцина и бактериального полисахарида, синтезируют антибиотикоподобные вещества ( бактериоцины ). Продукты жизнедеятельности нормальной микрофлоры кишечника, закисляя его содержимое, стимулируют его моторную функцию. Кроме того, метаболиты микрофлоры задействованы в энергообеспечении эпителиоцитов, регуляции нормальной пролиферации и дифференцировки клеток кишечника и др.
Ученые из педиатрической клиники Бостона и Гарвардского университета в сотрудничестве с учеными из медицинского университета Нью-Йорка (США) провели исследование, позволившее доказать, что применение пробиотиков у детей младше 5 лет сокращает продолжительность диареи.
Избыточный вес и ожирение, развитие сахарного диабета чаще отмечаются у детей с малым весом при рождении, не получавших грудного молока и рожденных от матерей с различными вариантами дисбиоза (гарднереллез, низкое содержание лактобактерий в кишечнике) [12]. Напротив, грудное вскармливание, здоровая микробиота в кишечнике матери определяют нормальное физическое и психическое развитие [14, 15]. Показано важное значение пробиотиков женщиной во время беременности и в период грудного вскармливания, так как предупреждает истощение лактобактерий (LGG) в постнатальном периоде. Показано, что микробиота матери вне зависимости от колонизации бактерий в неонатальном периоде стимулирует формирование иммунного ответа с помощью иммуноглобулинов грудного молока [16].
1.3. Коррекция микробиоты матери для профилактики возможных осложнений у ребенка
Большое число исследований посвящено изучению эффективности приема пробиотиков кормящими матерями. Доказано, что прием пробиотиков, содержащих LGG или бифидобактерии, во время беременности увеличивает содержание интерферона-гамма в крови и грудном молоке, что положительно влияет на иммунитет новорожденных 17. На основании рандомизированных контролируемых исследований R. Boyle и соавт. показали, что прием пробиотиков, содержащих Lactobacillus GG, во время беременности благоприятно влиял на иммунный статус и предупреждал развитие бронхиальной астмы и экземы у новорожденных [20].
Таким образом, прием пробиотиков женщиной в перинатальном периоде и в период лактации для улучшения колонизации кишечника ребенка является обоснованным на основании доказательств того, что бактерии передаются от матери к новорожденному через прямой контакт с материнской микрофлорой во время родов и через молоко в период грудного вскармливания.
S. Rautava и соавт. показали, что пробиотики в течение беременности и грудного вскармливания повышают устойчивость к атопии в дальнейшем [22]. Эффективность пробиотиков для профилактики атопических заболеваний продемонстрирована в систематических обзорах и метаанализе 24. По данным анализа базы Cochrane, проведенного D. Osborn, J. Sinn, было показано, что про- и пребиотики эффективны у младенцев для профилактики аллергии [24].
К настоящему моменту различные исследования продемонстрировали эффективность использования пробиотиков как амбулаторно, так и в стационаре во время подготовки к беременности и родам. Пробиотики, содержащие штаммы Lactobacillus acidophilus NCFM, L. paracasei Lpc-37, Bifidobacterium lactis Bi-07, B. lactis BI-04, Streptococcus thermophilus STY-31, Lactobacillus acidophilus W37 и W55, L. paracasei W72, L. plantarum W62, L. rhamnosus W71 и L. salivarius W24, благоприятно влияют на формирование микрофлоры в ранний неонатальный период и могут быть использованы для профилактики будущих заболеваний у ребенка (см. таблицу ) [26,27]. P. Mastromarino и соавт. показали, что комплексный пробиотик VSL#3, содержащий 8 штаммов пробиотиков (1 штамм Streptococcus thermophilus, 4 штамма Lactobacillus spp. и 3 штамма Bifidobacterium spp.), эффективно влияет на свойства грудного молока в зависимости от способа родоразрешения 30.
Таким образом, включение указанных штаммов в программу предродовой подготовки, периода беременности, вскармливания.
Клинические исследования, в которых изучались эффекты перорального приема пробиотиков у беременных женщин и рожденных ими детей, представлены в таблице.
Также пренатальный прием пробиотиков был связан со значительным увеличением количества Bifidobacterium и Lactococcus lactis (здоровая кишечная флора) в кишечнике матери и неонатальном кале ребенка. Побочных эффектов пробиотиков в этих исследованиях отмечено не было [33].
Введение матерям в течение 4 нед до и 3 нед после родов L. rhamnosus GG индуцировало специфические изменения в колонизации бифидобактериями кишечника новорожденных по сравнению с теми, кто получал плацебо. Младенцы в возрасте 5 дней, чьи матери получали L. rhamnosus GG, имели более высокую распространенность B. breve и низкую распространенность В. adolescentis, чем новорожденные, матери которых получали плацебо.
Эффективность пробиотиков в профилактике преждевременных родов оценивалась у женщин с их высоким риском, который достигал уровня 30—50%; полученные результаты свидетельствуют о снижении риска половых инфекций на 81% у этих женщин после приема пробиотиков [36,37].
Использование пробиотических бактерий во время беременности было предложено в качестве средства модуляции иммунной системы развивающегося плода для снижения риска иммунных аберраций и улучшения защиты хозяина. У матерей, принимающих пробиотики, было обнаружено значительное увеличение естественных клеток-киллеров в периферической крови и незначительное увеличение Т-лимфоцитов и В-лимфоцитов. В материнском молоке было выявлено снижение медиаторов инициального повреждения фактора некроза опухолей-альфа ( TNFα ). У грудных детей, матери которых употребляли L. casei, также было зарегистрировано меньше проблем с пищеварением, в том числе меньше случаев кандидоза полости рта, срыгивания, диареи, колик, запоров в период от 2 до 6 мес [34, 38].
Применение пробиотика L. rhamnosus GG беременными женщинами и их детьми уменьшило риск развития атопической экземы в течение первых 7 лет жизни [39]. L. rhamnosus GG назначался беременным женщинам, которые имели, по крайней мере, одного родственника первой степени родства с атопическим дерматитом, аллергическим ринитом или астмой, в течение 4 нед до предполагаемых родов и в течение 6 мес в послеродовом периоде. При приеме пробиотика беременной и кормящей женщиной увеличивалось количество противовоспалительного цитокина TGF-2 в молоке матери, что улучшало ее иммунозащитный потенциал и было связано с уменьшением риска атопической экземы в течение первых 2 лет жизни ребенка (15% по сравнению с 47%). Дети «атопических» матерей, особенно находящиеся на исключительно грудном вскармливании в течение 2,5 или 6 мес, имеют более высокий риск сенсибилизации в течение 1-го года жизни. Однако этот риск может быть снижен за счет использования пробиотиков во время беременности и в период лактации [40,41].
В группе детей, матери которых получали во время беременности пробиотики, было выявлено меньше случаев иммуноглобулин Е(IgE)-ассоциированных экзем в течение 2-го года жизни (8% по сравнению с 20%). Сравнительное изучение эффектов 2 пробиотиков — L. rhamnosus HN001 и Bifidobacterium animalis подвид lactis HN019 — проведено у беременных женщин и их детей. Младенцы, получавшие в этом исследовании L. rhamnosus, имели значительно меньший риск развития экземы [38]. Смесь пробиотических бактерий (Bifidobacterium bifidum W23, Bifidobacterium lactis W52 и Lactococcus lactis W58) назначалась беременным женщинам за 6 нед до родов и в течение 12 мес после, а также их младенцам, наблюдение продолжалось 24 мес. Частота экземы у детей «пробиотической» группы в течение первых 3 мес жизни была значительно ниже, чем в группе плацебо. Однако в возрасте 3 мес и до 2 лет заболеваемость экземой была одинаковой в обеих группах [39, 40].
C. Pelucchi и соавт. провели метаанализ рандомизированных контролируемых исследований по влиянию пробиотиков, применяемых во время беременности и в послеродовом периоде, на заболеваемость атопическим дерматитом и IgE-зависимым атопическим дерматитом. Получены доказательства эффективности пробиотиков в профилактике атопического дерматита и IgE-ассоциированного атопического дерматита у младенцев и детей. Благоприятный эффект не зависел от времени использования пробиотика (беременность или период лактации), а также объекта получения пробиотиков (мать, ребенок или оба) [44].
R. Bertelsen и соавт. изучали взаимосвязи между потреблением пробиотических молочных продуктов матерями во время беременности и лактации и развитием атопического дерматита, риноконъюнктивита и бронхиальной астмы у 40 614 детей. Потребление пробиотиков во время беременности было связано со снижением относительного риска (ОР) развития у младенцев атопического дерматита в первые 6 мес (ОР 0,94; 95% ДИ 0,89—0,99) и риноконъюнктивита между 18 и 36 мес (ОР 0,87; 95% ДИ 0,78—0,98) по сравнению с детьми, матери которых не принимали пробиотики [45].
K. Laitinen и соавт. исследовали эффекты пробиотиков в сочетании с диетой на метаболизм глюкозы у беременных женщин. Исследование включало три подгруппы беременных женщин в I триместре беременности. 1-я группа соблюдала диету (диета—плацебо), женщины 2-й группы получали пробиотики и соблюдали диету (L. rhamnosus GG и B. lactis BB12, диета—пробиотики), а 3-я группа получала плацебо (привычное питание и плацебо). Концентрация глюкозы в крови оставалась низкой в группе «диета—пробиотики» во время беременности и в течение 12 мес послеродового периода. Толерантность к глюкозе была в группе «диета—пробиотики» также выше, чем в группе «привычное питание—плацебо» в течение последнего триместра беременности и в период 12 мес после родов [46]. R. Luoto и соавт. обнаружили, что дети, рожденные женщинами, которые принимали пробиотики в III триместре беременности, имели статистически значимое снижение риска ожирения (p=0,035) и большой длины тела при рождении (p=0,028) [47].
Z. Asemi и соавт. провели сравнение показателей инсулинорезистентности (HOMA-IR) у женщин в III триместре беременности. Часть из них в течение 9 нед потребляли 200 г/сутки обычного йогурта, а другая часть — пробиотик, содержащий два штамма (Lactobacillus acidophilus LA5 и Bifidobacterium animalis BB12) с общим количеством 1×107 колонийобразующих единиц (КЕ). В отличие от обычного йогурта ежедневное потребление пробиотического йогурта в течение 9 нед снижало у беременных женщин сывороточный уровень инсулина и риск развития инсулинорезистентности [48].
1.4. Заключение
Таким образом, пробиотики показаны для беременных и кормящих женщин, так как:
Литература по 1-й части раздела (по 48 пункт) здесь →
2. НЕКОТОРЫЕ ФАКТЫ И РЕКОМЕНДАЦИИ
Изложенный выше материал убедительно показывает значимость пробиотической профилактики для мам и их будущих, а также новорожденных детей с целью укрепления иммунитета и предотвращения различных заболеваний в дальнейшей жизни. Однако краткий обзор основан на небольшом количестве исследований, а потому количество и виды используемых штаммов пробиотических микроорганизмов, указанные как рекомендуемые (с позиции доказательной медицины) ограничены рамками проанализированных работ. В связи с этим мы решили дополнить данный раздел некоторыми полезными заметками.
2.1 Пробиотики при беременности и подготовке к беременности
Микробиом младенца начинает развиваться в утробе матери.
Ведущая парадигма колонизации в раннем возрасте гласит, что плод развивается в стерильной среде внутриутробного развития и становится колонизированным микробами после рождения в процессе вагинального родоразрешения, кормления грудным молоком матери и других воздействий окружающей среды. Однако результаты исследования американских педиатров, в котором секвенирование следующего поколения выявило ДНК из различных ассоциированных с человеком бактерий в человеческой плаценте, амниотической жидкости (околоплодных водах) и меконии младенцев, позволяет утверждать, что первые столкновения с микробами могут происходить пренатально даже в условиях здоровой беременности.
Было установлено, что успешная беременность требует координации и баланса между материнским и развивающимся иммунитетом плода. Микробы играют важную роль в иммунном гомеостазе и регуляции. Наличие эмбриональных организмов или их молекулярных сигнатур может стимулировать иммунитет слизистой оболочки плода и подготавливать ткани к колонизации после рождения.
Микробиота беременной женщины обеспечивает ей метаболизм, необходимый для вынашивания здорового ребенка. Тип и количество бактерий, содержащихся в различных микробиоценозах и амниотической полости будущей матери, имеют важное значение для исходов беременности и рождения здорового ребенка.
При привычным невынашивании беременности (ПНБ) по данным МСММ у женщин в кишечнике наблюдается избыточный рост условно-патогенной флоры (УПФ) на фоне дефицита всей нормобиоты, особенно бифидобактерий и лактобацилл. Также, избыточный рост УПФ в сочетании с дефицитом нормофлоры напрямую был связан с сальпингитом и эндометритом. Выявленные зависимости свидетельствуют о значимой роли микробиоты кишечника в развитии дисбиоза матки и формировании ПНБ.
Во многом благодаря этим познаниям, репродуктологи, работающие по методике МСММ и учитывающие микробный фактор, стали иметь больше положительных результатов беременности, даже в случае обращений пациенток к таким специалистам после ряда неудачных ЭКО – ред..
Таким образом, пробиотики должны быть показаны не только беременным и кормящим женщинам, но и женщинам при подготовке к беременности, особенно из группы риска на инфекционные осложнения.
2.2. Постнатальное пробиотическое лечение детей.
Ведущая роль бифидобактерий и грудное вскармливание
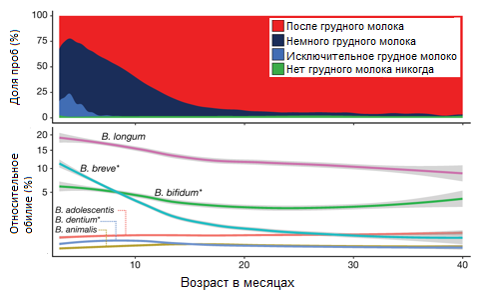
Младенцы, лишенные грудного вскармливания имеют больший риск развития многих заболеваний в более позднем возрасте, таких как аллергия и ожирение. Исследования укрепили важную роль грудного вскармливания в обеспечении хороших бактерий кишечника для младенцев на ранних стадиях их жизни. Так, например, группа специалистов из Университета Ньюкасла, Великобритания, установила, что Бифидобактерии изобилуют грудном в молоке и быстро сокращаются в кишечнике младенцев после прекращения грудного вскармливания. Нацеливание на питательные вещества в грудном молоке, которые стимулируют рост здоровых бактерий в кишечнике ребенка, или предоставление пробиотиков, содержащих бифидобактерии, представляют собой важные направления для вмешательств, направленных на восстановление полезных свойств грудного вскармливания, когда грудное молоко недоступно.
Рис. 1. Графики, показывающие получение грудного молока в возрасте от 3 до 40 месяцев по сравнению с относительным обилием шести наиболее распространенных видов бифидобактерий за тот же период (n = 11,717)
Пробиотическая защита недоношенных детей от некротизирующего колита (НЭК) и сепсиса
Дополнительная информация о пропионовокислых бактериях!
Потребление грудного молока человека (HBM) снижает частоту развития некротического энтероколита (NEC), который остается ведущей и трудноизлечимой причиной смертности недоношенных детей. В работе Colliou et al., 2017 сообщается, что это уменьшение коррелирует с изменениями в микробиоте кишечника, особенно с обогащением видов молочных пропионибактерий:
Предотвращение задержки роста детей
Что касается недоношенных детей, находящихся в отделении реанимации и интенсивной терапии, то чем более аномален (дисбиотичен) их кишечный микробиом, тем более вероятно, что они будут испытывать замедление роста даже в 4-летнем возрасте, что было установлено в исследовании Университетом Южной Флориды (USF Innovation).
В отношении других детей с задержкой роста влияние кишечного микробиома на их рост продемонстрировали сразу несколько независимых исследовательских коллективов, которые установили 3 основные причины:
Эксперт по инфекционным заболеваниям и кишечной микробиоте из Университета Виргинии в Шарлотсвилле Уильям Петри (William Petri) подчеркнул важность полученных данных, назвав их «переломным моментом в глобальном здравоохранении в целом и в диетологии в частности». Основная идея в лечении та же – обязательная пробиотическая профилактика (пробиотикотерапия).
2.3. Доказательства безопасности пробиотиков для будущих мам и новорожденных детей.
Снижение частоты инфекционных заболеваний, предотвращение аллергии, экземы и т.д.
В исследованиях была подтверждена долгосрочная безопасность и эффективность кормления пробиотической смесью. Смесь назначалась как беременным матерям, носившим детей с высоким риском развития аллергии (в течение от 2 до 4 недель до родов), так и их новорожденным младенцам (в течение 6 месяцев от рождения). В указанные смеси входили следующие пробиотические виды: Lactobacillus rhamnosus, Bifidobacterium breve и Propionibacterium freudenreichii ssp shermanii.
Следует отметить, что в рандомизированных выборках новорожденных была проанализирована бактериальная колонизация мекония (n = 131) и образцов фекалий через 3 (n = 98), 6 (n = 99) и 24 (n = 89) месяца для бактериального восстановления добавленных бактерий. Были проведены анализы на общее количество лактобацилл и бифидобактерий.
Это подтверждают и др. исследования. Так, например, в 2004 году в Индии в Махараштрском университете была проведена обширная по масштабу исследовательская работа, в которой объектами исследования служили 135 детей-добровольцев (от 2 до 5 лет) с желудочно-кишечными инфекциями. В результате данного эксперимента было установлено, что в группе детей, получавших ПКБ, выздоровление происходило быстрее, и в течении 3-х месяцев после лечения сохранялось стабильное состояние здоровья. Более того, у детей наблюдалась прибавка в весе, а через 15 дней в их кале в несколько раз возрастало количество бифидобактерий, лактобацилл и самих пропионибактерий, и резко снижалось количество клостридий, колиформных бактерий, стафилококков и энтерококков.
Дополнительная информация про безопасность бифидобактерий и классических («молочных») пропионовокислых бактерий:

Учитывая все данные изложенного выше материала, в т.ч. описанные пробиотические свойства молочных пропионовокислых бактерий P. freudenreichii и важную роль бифидобактерий в пробиотической профилактике для беременных женщин и новорожденных детей, а также доминирование среди бифидобактерий вида B. longum (в первые годы жизни ребенка), медицинским специалистам необходимо на практике (и более широко) использовать данный потенциал полезных микроорганизмов в сфере репродуктологии, акушерства и гинекологии и педиатрии. Тем более, что кроме усиления бифидогенной активности, симбиоз бифидо- и пропионовых бактерий имеет повышенные противоинфекционные и антимутагенные свойства, что ранее было установлено экспериментально.

Дополнительно см.:
Список литературы
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ