какие препараты нельзя при миастении принимать
Еще раз о наболевшем… Препараты, противопоказанные при миастении
Всем известно понятие ятрогенных заболеваний. Но меньше всего мы подозреваем себя в качестве этиопатогенетического фактора. В каких случаях лечащий врач может стать причиной обострения?
В патогенезе миастении ведущую роль играют аутоиммунные механизмы, направленные против ацетилхолинового рецептора(АХР) поперечно-полосатых мышц (80–90 % случаев). При так называемой серонегативной форме миастении, когда нет антител к АХР, выявляются антитела к специфической мышечной тирозинкиназе (MuSK, в 40 % случаев) или к липопротеиновому рецептору низкой плотности (Lrp4, в 9 % случаев). Показано, что пусковым механизмом при миастении кроме аутоиммунных могут бытьи неиммунные факторы, которые посредством каскада патологических реакций запускают аутоиммунные процессы. Среди причин, запускающих миастенический процесс, описан целый ряд лекарственных препаратов, непосредственно или опосредованно отрицательно влияющих на нервно-мышечную передачу (НМП). Многие из этих препаратов обладают иммуномодулирующими и иммуногенным потенциалом. В литературе описаны случаи дебюта миастениии развития миастенических кризов (МК) после внутривенного введения йодсодержащих контрастных веществ и даже ботулинического токсина типа А. Транквилизаторы бензодиазепинового ряда вызывают центральный миорелаксирующий эффект, имея участки связывания на ГАМК-ергических рецепторах. Нейролептики могут изменять иммунный ответ, блокируя взаимодействие серотонина и дофамина с рецепторами. Кураре-подобные миорелаксанты (D-тубокурарин, ардуан) экранируют участки связывания ацетилхолина (АХ) на АХР. Схожим эффектомобладают такие антибиотики, как аминогликозиды, которые нарушают выделение медиатора АХ, блокируя потенциал-зависимые кальциевые каналы пресинаптической терминали аксона. Купренил (D-пеницилламин) стимулирует продукцию антител к АХР и приводит к развитию синдрома, клинически не отличимого от миастении. В последние годы получены новые доказательства регуляции иммунного ответа и клинического течения миастении метимазолому пациентов с сопутствующей гиперфункцией щитовидной железы. Препараты магния подавляют высвобождение АХ из терминалей аксонов; последствия их негативного действия на НМП ряд исследователей сопоставляют с эффектом кураре. Достоверность этих наблюдений проверена многочисленными экспериментамии многолетним клиническим опытом. Во всех доступных руководствах по миастении имеются разделы с перечнем препаратов, назначение которых категорически исключается при подозрении на наличие у пациента патологии НМП. Несмотря на это продолжают встречаться случаи развития ятрогенной миастении. Обескураживают сообщения и рекомендации о введении магнезии в период обострения миастении с целью коррекции гипомагниемии, что приводит к развитию МК. Самое удивительное, что развитие угрожающего жизни состояния не останавливает врача, который уверенно вводит магнезию повторно и, конечно, получает очередной МК.
Вся статья>>>
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ И МИАСТЕНИЯ
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
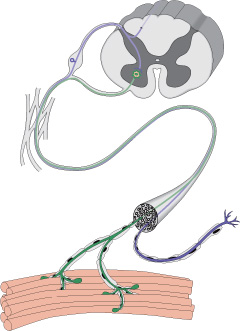
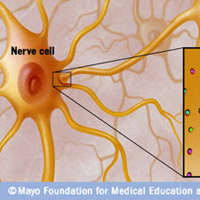
Миастения – заболевание нейромышечного соединения, при котором нормальная передача нейромышечного импульса нарушается или не допускается антителами к ацетилхолиновым рецепторам (АХР).
Индуцированная лекарственными препаратами миастения
Нарушение проведения нервного импульса к мышце вследствие действия фармакологических препаратов возможно на 4 уровнях:
• пресинаптическом (средства для местной анестезии);
• нарушение выхода АХ из пресинаптических везикул;
• блокада постсинаптических АХР (курареподобное действие);
• ингибирование распространения импульса в концевой пластинке двигательного нерва из-за прерывания постсинаптического потока ионов.
Применение ряда препаратов связано с риском индуцирования или обострения миастении. Рассматривая эти связи, авторы выделяют 3 степени (по убыванию) влияния препаратов: определенные, вероятные и возможные ассоциации.
Пеницилламин индуцирует ряд аутоиммунных заболеваний, включая миастению. У 70% больных с развившейся пеницилламининдуцированной миастенией (ПИМ) определяют антитела к АХР. Эти антитела антигенно сходны с таковыми при идиопатической миастении. Большинство больных, описанных в литературе, получали пеницилламин по поводу ревматоидного артрита. Предполагают, что препарат связывается с АХР и действует как гаптен, индуцируя образование антител к рецептору. Согласно другой теории, пеницилламин, усиливая продукцию простагландина Е1, способствует накоплению его в синапсе, что в свою очередь препятствует связыванию АХ с АХР. Поскольку ПИМ развивается преимущественно на фоне аутоиммунного заболевания, ряд авторов предполагают, что пеницилламин может демаскировать идиопатическую миастению.
Кортикостероиды являются важным дополнительным средством в лечении миастении. Однако использование данных препаратов ассоциируется с миопатией, возникающей обычно при их длительном применении в результате усиленного катаболизма в мышцах; она затрагивает преимущественно проксимальные скелетные мышцы. Кортикостероидиндуцированная миопатия может «наложиться» на миастению. Транзиторное обострение миастении при использовании высоких доз кортикостероидов часто встречается, и об этом следует помнить. Но это не значит, что нужно отказаться от назначения кортикостероидов при тяжелой миастении. Многие клиницисты используют кортикостероиды как препараты первой линии при обострениях миастении.
Антихолинергические препараты теоретически могут нарушать нейромышечную передачу в концевой пластинке двигательного нерва вследствие конкурентного подавления связывания АХ с постсинаптическими рецепторами. Описано возникновение миастенических симптомов у больного паркинсонизмом под влиянием тригексифенидила гидрохлорида.
Антибактериальные препараты (ампициллин натрий, имипенем и циластатин натрий, эритромицин, пирантел памоат) могут вызвать значительное ухудшение состояния и/или обострение симптомов миастении.
Сердечно-сосудистые средства. Описан случай усиления птоза и диплопии, присоединения дисфагии и слабости скелетных мышц у больной миастенией после приема пропафенона гидрохлорида, что связывают со слабым b-блокирующим эффектом данного препарата. Описан случай клинического ухудшения миастении на фоне лечения верапамилом гидрохлоридом. Этот эффект может быть связан с редукцией содержания внутриклеточного ионизированного кальция, что, в свою очередь, может нарушить обратный поток ионов калия.
Хлорохин фосфат – антималярийный и противоревматический препарат, способный индуцировать миаcтению, хотя и значительно реже, чем пеницилламин.
Блокаторы нейромышечной проводимости применяют при миастении с осторожностью в связи с риском развития длительных параличей. Предшествующее лечение пиридостигмином снижает ответ на недеполяризующие нейромышечные блокаторы.
Глазные препараты пропаракаин гидрохлорид (антимускариновый мидриатик) и тропикамид (местный анастетик) при последовательном применении вызвали внезапную слабость и птоз у больной миастенией.
Прочие лекарственные препараты. Ацетазоламид натрий снизил реакцию на эдрофониум у 7 больных миастенией, что, возможно, связано с подавлением карбоангидразы. При изучении гиполипидемического препарата декстрокарнитина-левокарнитина у 3 больных с терминальной стадией патологии почек развилась слабость жевательных мышц и мышц конечностей. На фоне лечения a-интерфероном описано 3 случая развития миастении. Обострение миастении зарегистрировано при назначении метокарбамола по поводу болей в спине. Рентгеноконтрастные препараты (иоталамическая кислота, диатризоат меглюния) в отдельных случаях вызывали обострение миастении, однако, по мнению авторов, миастения не является противопоказанием для применения рентгеноконтрастных препаратов.
Авторы пришли к заключению, что ряд препаратов при миастении следует назначать с осторожностью. Назначая новый препарат, следует проводить тщательное наблюдение на предмет выявления генерализованной мышечной слабости и особенно таких симптомов, как птоз, дисфагия, затруднение жевания, дыхательная недостаточность. Индукция ятрогенной миастении связана с применением пеницилламина.
Wittbrodt ЕТ, Pharm D. Drugs and Myasthenia Gravis. Arch Intern Med 1997;157:399–408.
Миастения
Симптомы
Мышечная слабость вызванная миастенией увеличивается в больных мышцах при повторных нагрузках на эти мышцы. Так как симптомы обычно уменьшаются после отдыха, мышечная слабость может появляться и исчезать. Симптомы миастении прогрессируют с течением времени и, как правило, наибольшего пика достигают через несколько лет после дебюта заболевания. Несмотря на то, что миастения может поразить любые из поперечно-полосатых мышц, определенные группы мышц вовлекаются в процесс чаще, чем другие.
Глазные мышцы
У более чем половины пациентов, у которых развилась миастения, первые симптомы связаны со зрением:
Примерно у 15 процентов пациентов с миастенией, первые симптомы затрагивают мышцы лица, и гортани что будет проявляться:
Мышцы конечностей и шеи
Причины
Нервы передают импульсы мышцам с помощью выброса химических веществ, называемых нейротрансмиттерами, которые попадают точно в рецепторы на мышечных клетках. При миастении, иммунная система вырабатывает антитела, которые блокируют или уничтожают много мышечных рецепторов нейротрансмиттера ацетилхолина. С уменьшением количества действующих рецепторов, мышцы получают меньше нервных сигналов, в результате это приводит к мышечной слабости.
Факторы, которые могут ухудшить течение миастении
Осложнения
Осложнения миастения обычно поддаются лечению, но некоторые из них могут быть опасны для жизни.
Миастенический криз
Миастенический криз является угрожающим жизни состоянием, которое возникает, когда мышцы, которые контролируют дыхание, становятся слишком слабыми для выполнения своих функций. В таких случаях требуется неотложная помощь для обеспечения дыхания и с использованием аппаратного дыхания. Медикаментозное лечение и фильтрация крови помогают пациентов выйти из миастенического криза и тогда они могут дышать самостоятельно
Опухоли тимуса
У приблизительно 15 процентов пациентов с миастенией отмечается наличие опухоли в вилочковой железы. Большинство этих опухолей доброкачественные.
Другие нарушения
У пациентов с наличием миастении, также нередко встречаются следующие проблемы:
Диагностика
Прежде всего, при подозрение на миастению пациента направляют на консультацию невролога. Врача-невролога могут интересовать подробное описание симптомов, наличие в анамнезе приема лекарств (дозировок), связь симптомов с физическими нагрузками. Врач-невролог проведет изучение неврологического статуса (рефлекторную активность, мышечную силу, мышечный тонус, координацию, зрение и осязание).
Основным признаком того, что указывает на возможность миастении, является слабость мышц, которая регрессирует после отдыха. Тесты, которые могут помочь подтвердить диагноз могут включать:
КТ или МРТ может быть назначено для исключения опухоли вилочковой железы.
Лечение
Врачи используют различные методы лечения, по отдельности или в комбинации, чтобы уменьшить симптомы миастении.
Лекарственные препараты
Хирургическое лечение
У 15 процентов людей, у которых есть миастения, также отмечается наличие опухоли в вилочковой железе. В таких случаях рекомендуется оперативное лечение и удаление опухоли.
Для пациентов с миастенией, у которых нет опухоли в вилочковой железе, удаление железы является достаточно спорным методом лечения.
Хирургическое вмешательство не рекомендуется большинством врачей, если:
Образ жизни
Использование материалов допускается при указании активной гиперссылки на постоянную страницу статьи.
Принципы лечения бронхолегочной инфекции у больных миастенией
Изучены больные с бронхолегочной инфекцией, протекающей на фоне миастении. При микробиологическом исследовании выявлены возбудители, чувствительные к применяемому антибиотику — цефаперазону/сульбактаму. С целью повышения клинической эффективности лечения
Patients suffered from bronchopulmonary infection with myasthenia gravis as a background were included in this study. The microbiological study showed bacteria sensitive to the cefoperazone/sulbactam. Intravenous immunoglobulins were prescribed with the objects of clinical effectiveness increase.
Миастения является классическим аутоиммунным заболеванием, в основе которого лежит аутоиммунный процесс, направленный против ацетилхолинового рецептора постсинаптической мембраны мышцы [1]. Ведущим звеном в развитии миастении является нарушение нейромышечной проводимости, что клинически выражается в развитии нарастающей мышечной слабости различной локализации. В настоящее время достигнуты большие успехи в изучении патогенеза заболевания, в диагностике, в подходах ведения и лечения различных групп больных миастенией [2]. Однако несмотря на патогенетическую терапию не существует специфических подходов полного излечения этого заболевания. Исход развития болезни зависит от эффективности подобранной терапии и скорости прогрессирования нарастающей мышечной слабости, которое может привести к полной невозбудимости определенных групп мышц.
Наиболее клинически значимым у больных миастенией является вовлечение в патологический процесс основной и вспомогательной дыхательной мускулатуры, что, в конечном итоге, выражается разной степенью дыхательной недостаточности [7]. Данные изменения приводят к нарушению вентиляционной функции легких, вызывая застойные явления, которые являются «благоприятными» для развития инфекционно-воспалительного процесса. В исследовании, проведенном в Госпитале Университета Джона Хопкинса с 1990–1998 г., было показано, что у 46% пациентов, испытывающих те или иные дыхательные нарушения на фоне миастении, развивается пневмония [3].
Важность развития инфекционного процесса связана с лечением, проводимым у больных различной формы миастениий. Помимо основной терапии антихолинэстеразными препаратами лечение миастении направлено на подавление активности аутоиммунного процесса, что осуществляется путем подавления общего иммунного ответа организма. В методы лечения миастении входит применение пульс-терапии глюкокортикостероидами, применение цитотоксических иммунодепрессантов (азатиоприн, циклофосфамид), тимэктомия. Перечисленные методы лечения в связи с подавлением иммунитета создают дополнительный фон для развития бактериальных осложнений. Важно отметить, что для некоторых лекарственных препаратов, например Циклофосфана, отмечено прямое токсическое действие на легочную ткань. Таким образом, роль инфекции при миастении очевидна [4].
Актуальность проблемы развития бронхолегочных заболеваний связана и со сложностью лечения подобных осложнений у больных с миастенией. Некоторые препараты, которые применяются в стандартной практике при лечении сопутствующих заболеваний (курареподобные препараты, D-пеницилламин, интерферон-альфа, соли магния, бета-блокаторы, блокаторы кальциевых каналов и т. д.), противопоказаны при миастении из-за их угнетающего воздействия на нейромышечную проводимость. К препаратам, которые абсолютно противопоказаны при миастении, также относятся некоторые антибиотики: аминогликозиды, макролиды, фторхинолоны. Это накладывает определенные ограничения у данных больных на лечение инфекционных осложнений (ИО), как уже было отмечено ранее, столь часто проявляющихся со стороны дыхательной системы.
Таким образом, из-за сложности лечения ИО у больных с миастенией возникает необходимость поиска новых подходов в терапии данной группы больных. К сожалению, при подготовке материалов не было найдено англоязычной литературы, посвещенной этой проблеме.
Целью настоящего исследования явилось изучить микробиологический пейзаж мокроты, трахеобронхиального секрета и оценить клиническую эффективность антибиотико- и иммунотерапии у больных с инфекционно-воспалительными заболеваниями на фоне миастении.
Материалы и методы исследования
Группу исследования составили 19 больных с генерализованной формой миастении (6 мужчин, 13 женщин; возраст больных составил от 22 до 81 года); из них 3 мужчин, 7 женщин — с обострением хронического трахеобронхита, 3 мужчин, 1 женщина — с остаточными признаками перенесенной госпитальной пневмонии; 2 женщины — с хроническим обструктивным бронхитом; 1 женщина — с синдромом Ламберта–Итона; 2 женщины — с бактериальной очаговой пневмонией (у одной из них — тимэктомия в анамнезе). Клинические признаки обострения инфекционного процесса были следующие: кашель со слизисто-гнойной мокротой, увеличение ее продукции, одышка, быстрая утомляемость, у некоторых больных наблюдался субфебрилитет. Перед началом лечения проводили общепринятое клинико-лабораторное исследование, изучение бактериологического состава мокроты, секрета из трахеи (или трахеостомы), исследования показателей функции внешнего дыхания (ФВД), рентгенографию или компьютерную томографию (КТ) грудной клетки.
Образцы, полученные от больных, доставляли в течение 2 часов в бактериологическую лабораторию, где проводилась микроскопия мазка для оценки качества биоматериала и посев на стандартные питательные среды. Образцы мокроты считались приемлемыми, если число лейкоцитов было больше 25, а число эпителиальных клеток — меньше 10 в одном поле зрения. При посеве выделенных возбудителей проводили видовую идентификацию (тест-системы BBL Crystal). Антибиотикочувствительность микроорганизмов определяли методом диффузии в агаре.
Тяжесть состояния и трудность лечения пациентов обусловлены иммунодефицитом и ятрогенией. Так, у одной пациентки имел место стеноз трахеи, развившийся вследствие длительной искусственной вентиляции легких, проводимой в связи с миастеническим кризом. У другого пациента был рак языка, в связи с чем больному была выполнена открытая трахеостомия. В этих случаях ситуация усугубляется: снижается иммунологическая защита, нарушается эвакуация трахеобронхиального секрета, что способствует колонизации нозокомиальными резистентными штаммами микроорганизмов и развитию гнойно-инфекционных осложнений. И еще у одного пациента тяжесть состояния усугублялась непосредственно приемом антихолинэстеразного препарата пиридостигмин (Калимин), назначаемого при миастении. На фоне приема пиридостигмина у больного усиливалось выделение мокроты до 300 мл/сут. В связи с этим пациент был вынужден отказаться от приема препарата и самостоятельно проводить позиционный утренний дренаж.
Аускультативная картина была скудной: дыхание везикулярное, ослабленное в нижнелатеральных отделах легких, локальные влажные и рассеянные сухие хрипы, частота дыхания в покое 18–20 в мин.
При исследовании ФВД выявлены вентиляционные нарушения. Снижение ОФВ1 составило в среднем от 60% до 49%.
В качестве антибиотикотерапии все больные получали цефоперазон/сульбактам внутривенно или внутримышечно в дозе 1,0 г 2 раза в сутки. Длительность терапии составила 7–10 дней (в зависимости от степени активности инфекционного процесса). С целью улучшения реологических свойств мокроты всем пациентам назначали муколитики (ацетилцистеин (Флуимуцил) по 300 мг 2 р/сут) через небулайзер или per os.
В программу лечения с иммунозаместительной целью был включен человеческий внутривенный иммуноглобулин G (ВВИГ: Октагам, Биавен В. И., Октаглобин). Лечение проводилось на фоне основной базовой терапии, включающей метилпреднизолон, пиридостигмин и хлористый калий.
Нам представляется важным описать клинический случай в данном исследовании. Больной 74 лет имел диагноз «генерализованная миастения» с декабря 2010 г. По тяжести состояния принимал 80 и 40 мг метилпреднизолона по альтернирующей ежедневной схеме. Обратился в августе 2012 года с жалобами на резкую слабость, быструю утомляемость, нарастающую одышку при незначительном физическом усилии. При объективном исследовании больного отмечено состояние средней тяжести, кожные покровы без видимой патологии, периферические лимфоузлы не увеличены, стопы пастозны. При перкуссии грудной клетки определялся коробочный звук, экскурсия с обоих сторон — 3 см (1,5 + 1,5). При аускультации — дыхание в проекции сегментов S4–5, S9 справа резко ослаблено, хрипы отсутствовали, число дыхательных движений сидя 18 в мин. ЧСС — 85 в мин, АД — 130/85 мм рт. ст., температура 36,8 °C. Пальпация живота безболезненна, абдоминальные органы не увеличены. Результаты лабораторного исследования представлены в табл. 1. На представленных снимках КТ органов грудной клетки слева в проекции сегментов S1–2 определяется полостное образование неправильной формы с неровными, несколько инфильтрированными контурами на фоне ограниченного пневмофиброза (рис. 1). Слева в проекции сегмента S9 — крупный инфильтрат неоднородной структуры (рис. 2). Была произведена диагностическая бронхоскопия: бронхи проходимы, слизистая бледно-розового цвета, атрофична. Заключение: хронический атрофический трахеобронхит II ст.
Итак, у больного на фоне миастении развилась пневмония с деструкцией легочной ткани. Этиологический фактор выявить не представилось возможным из-за отсутствия мокроты. Важно отметить, что на фоне длительного приема высоких доз метилпреднизолона у пациента появились признаки тромбоцитопении, проявляющиеся кожными кровоподтеками на теле, начат курс комплексной антибиотико- и иммунотерапии. Внутривенно капельно вводился цефоперазон/сульбактам в течение 10 дней. Одновременно вводился ВВИГ, курсовая доза составила 15,0 г. Проведенная терапия с включением ВВИГ позволила добиться более быстрой ремиссии инфекционно-воспалительного процесса, подтвержденной клинико-лабораторными данными и результатами повторных КТ исследований легких, где отмечена положительная динамика патологического процесса (табл. 1): повышение уровня тромбоцитов — до 131 × 10 9 /л, снижение лейкоцитоза до 15,0 × 10 9 /л, снижение уровня С-реактивного белка — до 5,0 мг/л.
Пациент консультирован эндокринологом: отмечаются жалобы на боли в спине при ходьбе и физических нагрузках, снижение роста на 4 см за 3 года, чувство усталости в спине сидя; при осмотре определяется грудной кифоз, результаты лабораторного обследования представлены в табл. 2.
По рентгенографии позвоночника в боковой проекции выявлены компрессионные переломы 1-го, 2-го поясничных позвонков. Двуэнергетическая рентгеновская абсорбциометрия: минеральная плотность костной ткани по Т-критерию в поясничном отделе позвоночника — 3,0 SD, минеральная плотность костной ткани по Т-критерию в шейке бедра — 2,0 SD.
Диагноз: лекарственный (глюкокортикоидный) остеопороз с компрессионными переломами тел позвонков. Рекомендовано: рациональное питание с увеличением употребления продуктов, богатых кальцием и витамином D, поддержание адекватной физической активности и выполнение упражнений с нагрузкой, соответствующей состоянию здоровья; альфакальцидол (Альфа Д3-Тева) 0,75 мкг ежедневно, ибандроновая кислота (Бонвива) 3,0 мл болюсно 1 раз в 3 месяца.
Результаты и обсуждение
Итак, клиническое исследование мокроты у больных с обострением хронического бронхита и пневмонии на фоне миастении позволило выявить неоднородность микробиологического пейзажа. Лидирующими возбудителями были грамположительные патогены, такие как S. pneumoniae, S. aureus, S. pyogenes (что составило 66,7%). Цефоперазон/сульбактам проявил высокую активность к этим штаммам микроорганизмов. Одновременно наблюдался рост грамотрицательных патогенов P. aeruginosa и Kl. pneumoniae (по 12,5% соответственно), которые были чувствительны к цефоперазону/сульбактаму. Некоторые грамотрицательные микроорганизмы представляли ассоциации P. aeruginosa с грибами рода Candida (4,2%), Kl. pneumoniae с S. pneumoniae (16,7%); в таких случаях назначалась фунгицидная терапия флуконазолом (Дифлюкан), что значительно улучшило течение болезни.
Инфекционный процесс респираторного тракта у данной группы больных протекал торпидно, несмотря на адекватную антимикробную терапию. Известно, что при миастении имеет место общая депрессия иммунной системы вследствие угнетения как специфических, так и неспецифических факторов защиты, что требует коррекции иммунных «поломок».
Важно отметить основные свойства использованного антибиотика. Цефоперазон/сульбактам проявил активность как к грамположительным, так и к грамотрицательным микроорганизмам, в том числе к P. aeruginosa. Кроме того, антибиотик стабилен к действию бета-лактамаз, благодаря необратимому ингибитору — сульбактаму, синергично повышающему эффективность применяемого антибиотика (до 4 раз снижается минимальная подавляющая концентрация цефоперазона в отношении чувствительных к нему штаммов микроорганизмов). Большое значение имеет хорошая переносимость больными препарата, т. е. антибиотик не влияет на нервно-мышечное проведение.
Итак, кроме дезинтоксикационной, антибактериальной и других видов терапии, в настоящее время широко используются ВВИГ при различной локализации инфекционно-воспалительного процесса [5–8]. ВВИГ (Октагам, Биавен В. И., Пентаглобин и др.) содержат репертуар антител, способных инактивировать широкий спектр антигенов. Иммуноглобулины являются фактором приобретенного иммунитета, осуществляющего опсонизацию инфекционных очагов, способствуют быстрой элиминации бактериального агента и его метаболитов, активируя целый каскад иммунных реакций.
Заключение
Многолетний опыт позволяет использовать ВВИГ в комплексной терапии бактериальной инфекции респираторного тракта. Значимо улучшается течение болезни, ускоряются сроки излечения больных, а главное — снижается риск колонизации резистентными штаммами микроорганизмов и, соответственно, риск повторного эпизода инфекции.
Литература
ГБОУ ДПО РМАПО МЗ РФ, Москва

.gif)
.jpg)
_575.jpg)
.gif)
.gif)