Как называется болезнь быстрое старение
Преждевременное старение
Физиологический процесс старения связан со снижением выработки абсолютно всех гормонов, накоплением свободных радикалов и мутационных ошибок ДНК, естественной гибелью клеток и тканей, обусловленной длиной теломер, а также, генетически запрограммированной предрасположенностью.
Возрастные изменения гормонального фона заключаются как в снижении уровня гормонов, так и в нарушении соотношения между ними.
К ускорению процесса физиологического старения организма приводят:
› стресс
› гипергликемия
› ожирение
› нарушение сна из-за нарушения циркадных ритмов
› тяжелые инфекционные заболевания
› длительное использование оральных контрацептивов
Как гормоны влияют на преждевременное старение
Гормоны стресса, такие как кортизол и адреналин, являются катаболиками – веществами, вызывающими метаболический распад белков, а следовательно мышечной и костной ткани, мозга, сердца, артерий, щитовидной железы, печени и т.д. Каждый физический признак старения, обусловленный стрессом, связан с одним или несколькими гормональными дефицитами. Например, крупные и мелкие морщины во множестве появляются после нескольких лет дефицита гормона роста и половых гормонов. При сохраняющемся хроническом стрессе все ресурсы организма направляются на выработку кортизола- главного антистрессового вещества организма. Это приводит к уменьшению выработки половых гормонов (тестостерона и эстрадиола), что еще больше ускоряет процесс преждевременного старения.
Повышение сахара крови (гипергликемия) снижает производство гормонов, которые в норме увеличивают уровень сахара в крови – кортизола, гормона роста, тестостерона, ДГЭА, андростендиона, эстрадиола, глюкагона. Эти «гипергликемические» гормоны отвечают за сохранение здоровья, включая внешний вид, когда их баланс в организме соответствует норме. Частое и неумеренное потребление пищи, повышающей сахар крови, сопровождается дефицитом гормонов и преждевременным старением.
Накопление избыточной жировой ткани также приводит к нарушению гормонального фона: снижению уровня и нарушению соотношения между гормонами. Гормональные изменения при ожирении точно такие же, как при физиологическом старении. Главные же изменения касаются половых гормонов. У мужчин в жировой ткани тестостерон превращается в эстрадиол, усугубляя тем самым возрастное снижение тестостерона. И чем больше жировой ткани, тем больше образуется эстрадиола. У женщин в жировой ткани из андростендиона образуется в повышенном количестве эстрон, обладающий очень слабой эстрогенной активностью. Но именно его метаболиты вызывают развитие как доброкачественных, так и злокачественных опухолей в организме. «Благодаря» этим метаболитам у людей с ожирением достоверно выше частота развития онкологических заболеваний.
Очень похожая картина имеется в организме молодой женщины, длительно принимающей комбинированные оральные контрацептивы (КОК).
Контрацептивный эффект КОК основан на подавлении выработки гормонов гипофиза ЛГ и ФСГ, стимулирующих созревание яйцеклеток и выработку собственных половых гормонов: эстрадиола, прогестерона, тестостерона. Синтетические (химические) аналоги половых гормонов не образуют естественных метаболитов, которые должны работать в головном мозге. Именно поэтому наиболее часто встречающимися побочными эффектами являются:
› перепады настроения, депрессия, подавленное настроение, мигрень из-за отсутствия метаболитов прогестерона, работающих в головном мозге.
› снижение или потеря полового влечения (либидо), уменьшение объема мышечной ткани из-за снижения уровня тестостерона.
Все побочные эффекты приводят к ухудшению не только качества жизни, но и преждевременному старению.
Преждевременное старение тела может происходить даже у очень молодых людей.
Преждевременное старение в молодости
После продолжительного стресса, чрезмерной физической активности, а также перенесенной тяжелой инфекции, молодые люди нередко приобретают синдром хронической усталости, которая в некоторых случаях сохраняется всю последующую жизнь; при этом на теле появляются признаки преждевременного старения. У них часто обнаруживается недостаток многих гормонов, причем сам дефицит невелик, но недостающие гормоны очень важны для поддержания трудоспособности.
Отсутствие корректирующего гормонального лечения приводит к тому, что эндокринные железы работают с максимальной производительностью в целях сведения к минимуму гормональной недостаточности, повышая риск эндокринного истощения.
Умеренные занятия аэробикой могут быть хорошим подспорьем для стимулирования функций организма, но без истощения энергетических резервов и без изнурительного расходования сил. Интенсивные и тяжелые упражнения приводят к чрезмерному расходованию гормонов и способны разрушать гормональный баланс. Повседневное или даже еженедельное выполнение подобных анаэробных упражнений не допускается в возрасте после 40 лет без проведения гормонального лечения, поскольку эти упражнения провоцируют снижение уровня гормонов, обусловленного возрастными особенностями.
Сон восполняет резервы гормонов в гипофизе, в щитовидной железе, надпочечниках, половых железах, обеспечивая выделение физиологического количества гормонов, потребляемых организмом на протяжении всего дня. В идеале человек должен иметь 8 часов полноценного сна в тёмное время суток. Длительность сна меньше 6 часов, равно как и отсутствие сна ночью и перенос его на дневное время, становится разрушительным для здоровья. Нарушение циркадных ритмов приводит к нарушению выработки гормона роста в гипофизе, кортизола в надпочечниках, половых гормонов и гормонов щитовидной железы. Организм задействует дополнительные резервы для ограничения вреда, который может быть нанесен недостатком таких гормонов, что в свою очередь, истощает резервы и ведет к преждевременному старению.
Для эффективного и безопасного гормонального лечения необходимо:
› Не превышать физиологические дозы.
› Принимать человеческие биоидентичные гормоны.
› Использовать максимально безопасные и эффективные пути введения гормонов.
› Обеспечить одновременную корректировку всех компонентов гормональной недостаточности.
› Проходить у врача периодический контроль.
Гормоны должны быть приведены в соответствие друг с другом. Основной целью лечения является обеспечения полного гормонального баланса в организме человека.
Большинство гормонов стимулирует действие и выделение других гормонов или замедляет их действие. Основополагающим принципом является достижение баланса, который позволяет обеспечить безопасное и эффективное лечение всех случаев гормональной недостаточности.
Обеспечение гормонального равновесия — непростая задача, которую может решить только врач, который назначит комплексную гормонально-заместительную терапию с тщательно подобранными гормонами и метаболическими веществами.
Прогерия и теломеры
Удлинение теломер обратило преждевременное старение клеток
Американским ученым удалось обратить преждевременное старение клеток, взятых у пациентов с прогерией, путем удлинения теломер с помощью РНК-терапии. Результаты работы опубликованы в Journal of the American College of Cardiology.
Теломеры представляют собой «насадки» на концах хромосом, которые обеспечивают репликацию (удвоение) ДНК при делении клеток. С каждым делением они укорачиваются, что ограничивает возможности клеток к размножению (максимально возможное число делений называется пределом Хейфлика). Укорочение теломер с возрастом служит одним из факторов старения организма. В клетках присутствует фермент теломераза, способный увеличивать длину теломер, однако он активен только в клетках, которым необходимо постоянно делиться (стволовых, половых, некоторых эпителиальных и большинстве злокачественных).
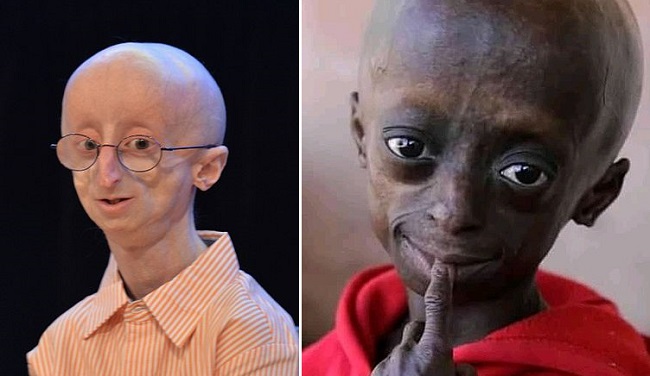
Прогерия Хатчинсона-Гилфорда – редкое генетическое заболевание, обусловленное мутацией гена LMNA, который кодирует белок ламин А, входящий в оболочку клеточного ядра. Дефектная форма этого белка, названная прогерином, нарушает архитектуру ядра, репарацию ДНК, многие другие биохимические процессы, а также резко ускоряет укорочение теломер. Все это приводит к быстрому старению организма – средняя продолжительность жизни при прогерии не превышает 13 лет.
Сотрудники Хьюстонского методистского исследовательского института с помощью монохромной мультиплексной количественной ПЦР измерили длину теломер в фибробластах 17 пациентов с прогерией возрастом от 1 до 14 лет, а также аналогичных клетках здоровых новорожденных и взрослых. У 12 пациентов эта длина соответствовала 69-летним здоровым людям, у остальных пяти она оказалась нормальной.
После этого ученые ввели в часть фибробластов пациентов с прогерией матричную РНК (мРНК), кодирующую человеческую теломеразу (hTERT), а в остальные – мРНК, кодирующую каталитически инертную форму этого фермента (CI hTERT), которая связывается с теломерами, но не удлиняет их. Процедуру повторили трижды с интервалом в 48 часов, что привело к стабильной экспрессии мРНК в течение нескольких дней.
РНК-терапия обычной hTERT восстановила пролиферацию фибробластов с укороченными теломерами, уменьшила потерю клеток в культуре и продлила срок жизни клеток. Это сопровождалось признаками омоложения фибробластов, в том числе увеличением активности теломеразы и длины теломер, снижением секреции воспалительных цитокинов и другими (авторы намерены подробно описать их в последующих публикациях). В целом кинетика роста клеток приблизилась к нормальной, но иммортализации (приобретения способности к неограниченному размножению и злокачественному перерождению) клеточной культуры не наблюдалось.
Введение CI hTERT в дефектные фибробласты и hTERT – в фибробласты с нормальной длиной теломер подобных эффектов не производили, то есть за них отвечало именно восстановление длины укороченных теломер.
«Полученные результаты свидетельствуют, что временная экспрессия мРНК теломеразы может служить быстрым и эффективным методом обращения старения клеток при прогерии. Хотя длительная экспрессия теломеразы может вызвать опасения, связанные с иммортализацией, наш подход не привел к перерождению клеток», – пишут авторы работы. В дальнейшем они намерены усовершенствовать методику так, чтобы адаптировать ее к клиническому применению.
Ранее ученым удалось замедлить старение клеток мышей с аналогом прогерии временным «включением» факторов транскрипции, преобразующих зрелые клетки в стволовые. Также был создан орган-на-чипе для изучения реакции клеток пациентов с прогерией на механическую деформацию.
Публикации в СМИ
Прогерия
Прогерия — патологическое состояние, характеризующееся преждевременным старением организма (появление дряблой кожи, алопеции, «птичьего лица» и т.д.).
• Прогерия взрослых (Вернера синдром) (*277700, 8p12, дефект гена WRN, r ) проявляется склеродермоподобными изменениями кожи (особенно конечностей) и скелетных мышц, развитием катаракты, гипогенитализма, преждевременного артериосклероза, инсулярной недостаточности, повышенным риском развития остеосаркомы; наблюдают чаще у мужчин в возрасте 20–30 лет.
• Прогерия детская (176670, Â ) проявляется пропорциональной карликовостью, алопецией, микрогнатией, преждевременным артериосклерозом, отсутствием подкожной клетчатки и рецидивирующими патологическими переломами « Гилфорда синдром « Гартингса синдром « Геродермия детская « Гетчинсона (Хатчинсона)–Гилфорда болезнь.
• Синдром преждевременного старения (тип Oкамото) (601811, r ). Клинически: •• Нарушения роста и нормального развития •• Повышенный риск развития остеосаркомы •• Микроцефалия •• Уплощение носа •• Катаракта •• Деформация ушей •• СД •• Остеопороз •• Макроцитоз эритроцитов.
• Синдром преждевременного старения (тип Пенттинен) (601812, r ). Клинически: •• Нормальные рост и интеллект •• Задержка костного возраста и прорезывания зубов •• Акроостеолиз •• Брахидактилия •• Сливные очаги уплотнения кожи, напоминающие юношеский гиалиновый фиброматоз кожи •• Дальнозоркость •• Нейросенсорная тугоухость. Лабораторно: повышение уровня ТТГ в крови.
МКБ-10 • E34.8 Другие уточнённые эндокринные расстройства
Код вставки на сайт
Прогерия
Прогерия — патологическое состояние, характеризующееся преждевременным старением организма (появление дряблой кожи, алопеции, «птичьего лица» и т.д.).
• Прогерия взрослых (Вернера синдром) (*277700, 8p12, дефект гена WRN, r ) проявляется склеродермоподобными изменениями кожи (особенно конечностей) и скелетных мышц, развитием катаракты, гипогенитализма, преждевременного артериосклероза, инсулярной недостаточности, повышенным риском развития остеосаркомы; наблюдают чаще у мужчин в возрасте 20–30 лет.
• Прогерия детская (176670, Â ) проявляется пропорциональной карликовостью, алопецией, микрогнатией, преждевременным артериосклерозом, отсутствием подкожной клетчатки и рецидивирующими патологическими переломами « Гилфорда синдром « Гартингса синдром « Геродермия детская « Гетчинсона (Хатчинсона)–Гилфорда болезнь.
• Синдром преждевременного старения (тип Oкамото) (601811, r ). Клинически: •• Нарушения роста и нормального развития •• Повышенный риск развития остеосаркомы •• Микроцефалия •• Уплощение носа •• Катаракта •• Деформация ушей •• СД •• Остеопороз •• Макроцитоз эритроцитов.
• Синдром преждевременного старения (тип Пенттинен) (601812, r ). Клинически: •• Нормальные рост и интеллект •• Задержка костного возраста и прорезывания зубов •• Акроостеолиз •• Брахидактилия •• Сливные очаги уплотнения кожи, напоминающие юношеский гиалиновый фиброматоз кожи •• Дальнозоркость •• Нейросенсорная тугоухость. Лабораторно: повышение уровня ТТГ в крови.
МКБ-10 • E34.8 Другие уточнённые эндокринные расстройства
Прогерия (от греч. progērōs преждевременно состарившийся) — патологическое состояние, характеризующееся комплексом изменений кожи, внутренних органов, обусловленных преждевременным старением организма. Основными формами является детская прогерия (синдром Гетчинсона — Гилфорда) и прогерия взрослых (синдром Вернера).
Детская прогерия наблюдается очень редко. Этиология и патогенез не известны. В большинстве случаев встречается спорадически, в нескольких семьях зарегистрирована у сибсов, в т.ч. от кровнородственных браков, что свидетельствует о возможности аутосомно-рецессивного типа наследования.
В клетках кожи больных обнаружены нарушения репарации ДНК и клонирования фибробластов, а также атрофические изменения эпидермиса и дермы, исчезновение подкожной клетчатки. Хотя детская П. может быть врожденной, у большинства больных клиническими признаки проявляются обычно на 2—3-м году жизни.
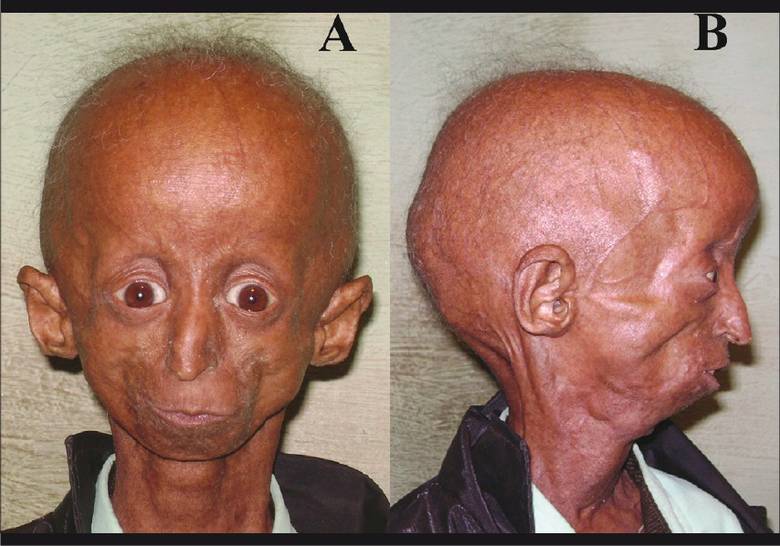
Резко умедляется рост ребенка, отмечаются атрофические изменения дермы, подкожной клетчатки, особенно на лице, конечностях. Кожа истончается, становится сухой, морщинистой, на туловище могут быть склеродермоподобные очаги, участки гиперпигментации. Сквозь истонченную кожу просвечивают вены. Внешний вид больного: большая голова, лобные бугры выступают над маленьким заостренным («птичьим») лицом с клювовидным носом, нижняя челюсть недоразвита.
Наблюдаются также атрофия мышц, дистрофические процессы в зубах, волосах и ногтях; отмечаются изменения костно-суставного аппарата, миокарда, гипоплазия половых органов, нарушение жирового обмена, помутнение хрусталика, атеросклероз.
За год Лена стареет на пять лет
Жительнице России по имени Лена всего 23 года, но выглядит она лет на сорок. Недавно в московской клинике ей сделали пластическую операцию на лице. Глаза у Лены молодые, но все остальное. Ее тело преждевременно и очень быстро стареет.
По словам Лены, сначала она заметила. что у нее начали странно отвисать мочки ушей, потом появились морщины между бровями, причем сразу глубокие, как у старых людей. При взгляде на Лену, сложно даже поверить, что ей чуть больше двадцати.
Лена в свои 23 года
Спрашивать у нее про личную жизнь кажется очень сложным делом, но Лена улыбается и говорит, что с этим у нее все в порядке. Но вот шансов на выздоровление у нее никаких нет. Прогерия неизлечима и никаких операции не помогут. В среднем больные прогерией, у которых она врожденная, живут не более 13 лет. Лене «повезло» лишь в том, что прогерия у нее проявилась не с детства.
Симптомы прогерии у нее начались в 17 лет. Обвисли мочки ушей, появились морщины, в основном пострадало лицо. Затем начала стареть кожа и на других частях тела. В то время Лена училась на 1-м курсе Марийского политехнического института и ей было очень неловко и обидно, что когда она гуляла с подругой-сверстницей, все принимали их за маму с дочкой.
После окончания института Лена решилась на пластическую операцию по подтяжке кожи лица, но это не помогло, загадочное быстрое старение ее организма продолжалось, а местные врачи не могли посоветовать Лене ничего, кроме витаминов.
В конце концов Лена решилась поехать в Москву, в клинику пластической хирургии «Бьюти Плаза». Когда там узнали о ее странной болезни, то решили помочь Лене совершенно бесплатно. А после операции ей пообещали курс индивидуальной программы по лечению стволовыми клетками.
К числу особенностей таких больных относятся карликовый рост, малый вес (не превышающий обычно 15-20 кг), чрезмерно тонкая кожа, плохая подвижность суставов, недоразвитый подбородок, маленькое лицо в сравнении с размером головы, что придает человеку как бы птичьи черты. Из-за потери подкожного жира видны все сосуды. Голос обычно высокий. Умственное развитие соответствует возрасту. И все эти больные дети поразительно друг на друга похожи.
12-летний Сет Кук выглядит как 80-летний старик. У него нет волос, зато есть полный набор заболеваний, которыми страдают пожилые люди. Поэтому каждый день мальчик принимает аспирин и другие лекарства, разжижающие кровь. При росте в 3 фута (чуть более метра) Сет весит 25 фунтов (11,3 кг).
Оури Барнетт родился 16 апреля 1996 года. Уже в пятилетнем возрасте у бедняги Оури началась ишемическая болезнь сердца. Приступы следовали один за другим. Малыш нередко попадал в больницу, но лечить его приходилось теми средствами, что обычно предписывают пожилым людям.
Оури был похож на человека, пережившего инсульт: у него слабели ноги, и он начинал спотыкаться, словно дряхлый старичок. Его глаза угасали, верхняя губа не двигалась, текла слюна, речь становилась неразборчивой.
До последнего времени врачам не удавалось определить причину возникновения недуга. И лишь недавно американские исследователи обнаружили, что причиной «детской старости» или прогерии Хатчинсона-Гилфорда является лишь одиночная мутация.
По словам директора Национального института исследования генома Френсиса Колинза (Francis Collins), руководившего исследованием, эта болезнь не является наследственной. Точечная мутация – когда в молекуле ДНК изменен лишь один нуклеотид – возникает заново у каждого больного. Люди, страдающие прогерией, умирают главным образом именно от тех хворей, что характерны для глубокой старости. Теперь обнаружено, что прогерию вызывает мутированная форма гена LMNA.
Семилетний старик и его семья
Дети Ханов. Рехена, Али Хусейн и Икрамул страдают от редчайшей болезни. Ему только семь лет, а он уже лысеет. Это самый заметный из многих симптомов недуга, которым страдает Али Хусейн Хан. Он еще мальчик, но он уже находится в среднем возрасте. Эта прогерия, чрезвычайно редкое заболевание, из-за которого организм Али преждевременно стареет.
Эта болезнь во много раз ускоряет развитие детей. Впрочем, вызывает она и другие проблемы: у них во рту, например, появляется второй ряд зубов, а кожа становится очень бледной, почти прозрачной.
Такие дети заболевают тем, чем обычные люди страдают в пожилом возрасте. В прошлом году их сестра Равена, тоже страдавшая прогрерией, умерла от пневмонии. Ей было 16.
Как только Али Хусейн начинает говорить, становится понятно, что он охвачен детским энтузиазмом и поглощен надеждами, не характерными для взрослого человека.
Ханы в этом смысле уникальна: это единственный известный науке случай, когда прогрерией страдает более одного члена семьи. И благодаря этой семье ученые сумели сделать настоящий прорыв в понимании природы болезни.
В последние два года за Ханами присматривает Сехар Чаттопадхьяй, руководитель благотворительного дома «Эс-би Деви» в Калькутте. Теперь они живут в этом городе, хотя их точный адрес держится в секрете.
Благотворительная организация помогла отцу найти работу охранника, но зарплата у него небольшая, так что им помогают и финансово. Но ничуть не менее важны, чем деньги, те нормальные человеческие контакты, которыми обзавелись дети при помощи благотворительной организации.
Благодаря его поддержке, говорят Ханы, они теперь живут куда более полной жизнью, чем раньше. Они улыбаются, когда рассказывают о своих интересах и увлечениях.
Медицинские интернет-конференции
Языки
Преждевременное старение и его генетически обусловленные формы
Филоненко Е.В., Долгов А.А.
Резюме
Генетически обусловленные формы преждевременного старения (прогерии) характеризуются многократным ускорением процессов старения, но их развитие обусловлено, преимущественно, мутациями конкретных генов. При синдроме Хатчинсона-Гилфорда вследствие мутации гена LNMA происходит нарушение структуры ядерной ламины, при синдроме Вернера мутация гена WRN приводит к сбою репликации и репации ДНК, при синдроме Луи-Бар мутация гена ATM приводит к нарушению передачи сигнала о повреждении ДНК. Комплексное изучение молекулярно-генетических механизмов прогерий разных форм имеет большое значение для понимания биологического старения в целом и для возможного создания в будущем «лекарств от старения».
Ключевые слова
Статья
Научный руководитель: д.б.н., доцент Дурнова Н.А.
Введение: Старость – неизбежный период жизни человека, характеризующийся снижением компенсаторных возможностей организма. Старость является результатом биологического процесса – старения, длительного детерминируемого процесса возрастных изменений организма, которые протекают под действием различных механизмов на клеточном, субклеточном и молекулярно-генетическом уровнях [1].
Цель обзора: краткий обзор основных механизмов биологического старения и анализ особенностей генетически обусловленных форм преждевременного старения.
Среди многочисленных потенциальных факторов, влияющих на продолжительность жизни, одним из наиболее известных на сегодняшний день является скорость укорочения концевых участков эукариотических хромосом – теломер [2,3,4,6]. В 1973 г. А.М. Оловников пришел к выводу, что при каждом делении клетки теломерные районы ДНК укорачиваются, тем самым выполняя своеобразную буферную функцию, предохраняя более значимые информационные области ДНК от концевой недорепликации [5]. Исходя из «теломерной» теории старения, общее число делений клеток ограничено неким пределом — лимитом Хейфлика [7], а уменьшение пролиферативного потенциала клеток, в свою очередь, обуславливает появление заболеваний, ассоциируемых со старением [8]. Тем не менее, четкой корреляции между длиной теломерных участков и возрастом доноров обнаружено не было, так как значения длин теломер для людей даже одинакового возраста имеют достаточно широкий разброс. Существует мнение, что длина теломер является скорее индивидуальной характеристикой, чем маркером биологического возраста, и зависит от множества факторов, в том числе и от психоэмоционального состояния человека [9,10]. Определенную роль в биологическом старении клеток играют эпигенетические механизмы, такие как метилирование ДНК, посттранскрипционные модификации коровых гистонов и динамические преобразования хроматина [11]. Доказано, что уровень метилирования ДНК в стареющих клетках существенно снижается; возможными причинами этого могут быть пассивное деметилирование гетерохроматина, а также потеря эффективности ДНК-метилтрансферазы (DNMT1) [12]. Различные модификации коровых гистонов (H2A, H2B, H3 и H4), которые не только обеспечивают укладку ДНК в ядре, но и активно участвуют в регуляции транскрипции, являются важным механизмом эпигенетической регуляции структуры и функций хроматина. При изучении «гистонового кода старения» было, например, установлено, что в клеточных культурах, полученных от престарелых доноров, интенсивность, с которой снижается количество клеток, содержащих триметилированные модификации Н3-гистона, прямо пропорционально зависела от возраста [13]. Еще одним важным компонентом регуляции гетерохроматина является белок HP1, уровень экспрессии и локализацию которого также можно рассматривать в качестве эпигенетического маркера [14]. HP1 принимает участие в одном из важнейших механизмов инактивации генов — упаковке замалчиваемых генов в репрессивные гетерохроматиновые домены. Показано, что уменьшение уровня HP1 в клетке вызывает дефекты кинетохора, или аберрантную хромосомную сегрегацию [15]. Существуют неопровержимые доказательства, что клеточные механизмы и сигнальные пути, регулирующие старение, контролируются mTOR и опухолевым супрессором p53. Хотя функции mTOR полностью не изучены, но известно, что киназа mTOR интегрирует многочисленные вне- и внутриклеточные сигналы, являясь регулятором пролиферации. Белок р53 активируется после генотоксического стресса и блокирует клеточный цикл, тем самым предотвращая размножение генетически дефектных клеток, т.е. выступает как хранитель геномной стабильности. Но в определенных случаях, при наличии блока клеточного цикла, вызванного влиянием р53, и одновременно высокой активности mTOR, происходит стимуляция гипертрофического роста клеток, который является одним из маркеров клеточного старения [16]. Одним из наиболее широко известных механизмов биологического старения является воздействие на клетку свободных радикалов, под влиянием которых происходит поражение митохондрий, накопление мутаций, деструкция клеточных мембран и другие патологические процессы. Противодействию влиянию свободных радикалов способствует поступление в организм антиоксидантов, отдающих радикалам свои электроны, и способствующих прекращению негативных процессов разрушения клеток [17]. Старение организма, безусловно, происходит под влиянием не одного определенного механизма, а многих взаимосвязанных между собой процессов. Ускоренное, или преждевременное старение может наступить, например, под воздействием на организм различных окружающих факторов и/или неправильного образа жизни. Но существуют генетически обусловленные формы преждевременного старения (прогерии), при которых скорость патологических изменений, характерных для старения, ускорена во много раз. Изучение прогерий было начато еще на рубеже XIX—XX вв.: О. Вернер клинически описал фенотипа больного прогерией взрослых, а Д. Хатчинсон и Г. Гилфорд описали случай прогерии детей. Позднее эти синдромы, получившие свои названия по именам впервые описавших их врачей, а также другие прогерии (в том числе атаксия-телеангиэктазия, или синдром Луи-Бар), были объединены под общим названием «синдромы преждевременного старения» [18]. При синдроме Хатчинсона-Гилфорда (Hutchinson-Gilford progeria syndrome – HGPS), проявляющемся в детском возрасте, происходит нарушение структуры ядерной ламины, причиной которого является или мутация гена LNMA (1q21.2), кодирующего ламин А/С, или гена FACE-1/ZMPSTE24 (1p34), кодирующего металлоротеазу, принимающую участие в посттрансляционных модификациях ламина А/С [19], которая приводит к делеции 50 аминокислот в предшественнике белка ламина А преламине А. Белок преламин А (прогерин) вмещает CAAX мотив, запускающий 3 последовательные ферментативные реакции, но делеция 50 аминокислот предотвращает его последующий процессинг в зрелый ламин А, что приводит к накоплению прогерина в нуклеоплазме ядра. Это обуславливает нестабильность ядерной оболочки – происходит образование инвагинаций или блеб-структур. В результате этого гетерохроматин теряет сцепление с ядерной оболочкой и «спутывается», что нарушает его взаимодействия с РНК-полимеразой II, факторами сплайсинга РНК, факторами транскрипции, приводя в беспорядок экспрессию генов [20,21,22,23]. У людей с детской прогерией теломеры оказались резко укороченными от рождения, лимит Хейфлика понижен. А эффект ламинопатии приводит к снижению эпигенетической регуляции, и, как следствие, в клетке наблюдается нарушение репарационных механизмов, в данном случае происходит не снижение активности фермента репарации ДНК, а снижается доступность для ферментов этих повреждений ДНК в составе хроматина клеток [24]. Синдром Вернера проявляется в подростковом или взрослом возрасте и относится к группе прогерий с генетическими дефектами репарационных факторов, так как в его основе лежат мутации в гене WRN (8p12-p11.2), кодирующем геликазу из семейства RECQ. Нарушение функций ДНК-геликазы вызывает сбой репликации и репарации ДНК, нарушение экспрессии генов, ускоренное укорочение теломер и повышенную чувствительность клеток к апоптозу. В клетках, полученных от доноров с синдромом взрослой прогерии, теломеры оказались укороченными от рождения [24]. В третью группу прогерий были выделены те патологические состояния, при которых нарушена передача сигнала о повреждении ДНК, как это происходит при атаксии-телеангиэктазии (синдроме Луи-Бар), причиной которой являются мутации в гене ATM (11q.23.1). Атаксия-телеангиэктазия (АТ) характеризуется рядом невралгических нарушений в сочетании с симметричными телеангиэктазиями, иммунодефицитом и повышенной частотой злокачественных новообразований. Клетки больных с АТ имеют характерные признаки преждевременного старения – ограниченную пролиферативную способность и наличие резко укороченных теломер от рождения [25]. Старение – стохастический регулируемый процесс, который происходит под влиянием многих взаимосвязанных между собой факторов, но в норме оно является строго детерминированым и регулируется через определенные внутриклеточные сигнальные пути. Процессы, протекающие в организме больных с генетически обусловленными формами преждевременного старения, являются, по сути, ускоренными во много раз процессами, характерными для старения здорового человека. В связи с этим, комплексное изучение молекулярно-генетических механизмов прогерий разных форм имеет большое значение для понимания биологического старения в целом и для возможного создания в будущем «лекарств от старения».
Литература
2. Смирнова Т.Ю., Рунов А.Л.¸ Бонский М.С., Спивак Д.Л., Захарчук А.Г. Длина теломер в группе долгожителей северо-западного региона России // Цитология. 2012. Том 54. №12. С. 439-446.
3. Blackburn, E.H. Switching and Signaling at the Telomere // Cell. 2001. №106. P. 661-673.
4. Mirsi S., Pandita S., Kumar R., Pandita T. K. Telomers, histone code, and DNA damage response // Cytogenet. Genome Res. 2008. №122 V. 3-4. P. 297-307.
5. Оловников А.М. Принцип маргинотомии в матричном синтезе полинуклеотидов // ДАН СССР. 1971. Том 201. №6. С. 1496-1499.
6. Грач А.А. Особенности структурной организации теломер у различных видов организмов // Цитология. 2009. Том 51. №11. С. 869-879.
7. Hayflick L., Moorhead P.S. The serial cultivation of human diploid cell strains // Exp. Cell Res. 1961. V. 253, P. 585-621.
8. Mikhelson V. M., Gamaley I. A. 2008. Telomere shortening is a sole mechanism of aging in mammals // Open Longevity. V. 2. №1. P. 23-28.
9. Albert G., Lansdorp P. M. Telomeres and aging // Physiol Rev. 2008. №88. P.557-579.
10. Frenck R.W Jr., Blackburn E. H., Shannon K. M. The rate of telomere sequence loss in human leukocytes varies with age // Proc. Nat. Acad. Sci. USA. 1998. №95. P. 5607-5610.
11. Jenuwein T, Allis C.D. 2001. Translating the histone code // Science. №293. P. 1074-1080.
12. So K., Tamura G., Honda T., Homma N., Waki T., Togawa N., Nishizuka S., Motoyama T. Multiple tumor suppressor genes are increasingly methylated with age in non-neoplastic gastric epithelia // Cancer Sci. 2006. №97. P. 1155-1158.
13. Scaffidi P., Misteli T. Lamin A-dependent nuclear defects in human aging // Science. 2006. №312. P. 1059-1063.
14. Li Y, Kirschmann D. A., Wallrath L. L. Does heterochromatin protein 1 always follow code? // Proc. Nat. Acad. Sci. USA. 2002. №99. P. 16462-16469.
15. Ekwall K., Javerzat J. P., Lorentz A., Schmidt H., Cranston G., Allshire R. The chromodomain protein Swi6: a key component at fission yeast centromeres // Science. 1995. №269. P. 1429-1431.
16. Зубова С. Г., Шитикова Ж. В., Поспелова Т. В. TOR-центрическая концепция регуляции митогенных, метаболических и энергетических сигнальных путей в клетке. 2012. Цитология. Том 54. №8. С. 589-602.
18. Михельсон В. М. 1996. Наследственное преждевременное старение человека // Клин. геронтол. №4. С. 410.
19. Shackleton S., Smallwood D. T., Clayton P., Wilson L. C., Agarwal A. K, Gard A., Trembath R. C. Compound heterozygous ZMPSTE24 mutations reduce prelamin A processing and result in a severe progeroid phenotype. J. Med. Genet. 2005. №42. е36.
20. Scaffidi P., Misteli T. Reversal of the cellular phenotype in the premature aging disease Hutchinson—Gilford progeria syndrome // Nature Med. 2005. №1. P. 440—445.
21. Reddel C. J., Weiss A. S. Lamin A expression levels are unperturbed at the normal and mutant alleles but display partial splice site selection in Hutchinson-Gilford progeria syndrome // J. Med. Genet. 2004. №41. P. 715-717.
22. Goldman R. D., Shumaker D. K., Erdos M. R., Eriksson M, Goldman A. E., Gordon Y., Gruenbaum L. B., Khuon S, Mendez M, Varga R., Collins F. S. Accumulation of mutant lamin A causes progressive changes in nuclear architecture in Hutchinson—Gilford progeria syndrome // PNAS. 2004. №101. P. 8963-8968.
23. Csoka A. B., English S. B., Simkevich C. P., Ginzinger D. G., Butte A. J., Schatten G. P., Rothman F. G., Sedivy J. M. Genome-scale expression profiling of Hutchinson-Gilford progeria syndrome reveals widespread transcriptional misregulation leading to mesodermal/mesenchymal defects and accelerated atherosclerosis // Aging Cell. 2004. №4. P. 235-243.
24. Смирнова Н.В., Спивак И.М., Плескай Н.М., Михельсон В.М. Атипический случай синдрома Вернера: эффект ламинопатии. Цитология. 2008. Том 50. №9. C. 780-788.
25. Полуботко Е.А., Смирнова Н.В., Плескач Н.М., Михельсон В.М., Спивак И.М. Особенности преждевременного старения при атаксии-телеангиэктазии // Цитология. 2009. Том 50. №8. С. 712-718.