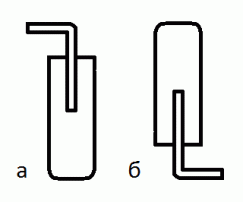как можно установить присутствие водорода в пробирке
Опыт. Получение и собирание водорода. Доказательство наличия водорода в пробирке



Водород можно получить взаимодействием цинка с соляной кислотой:
Водород легче воздуха, поэтому его собирают в пробирку, перевернутую дном кверху.
Чтобы доказать наличие водорода в пробирке и проверить его на чистоту, пробирку с водородом подносят к пламени спиртовки (пробирку держим держателем для пробирок!). Чистый водород сгорает со звонким хлопком.
Если водород смешан с воздухом, звук будет визгливый, говорят «сгорает со свистом».
Опыт доказательства наличия водорода не всегда получается, особенно без тренировки – нужно накопить довольно много водорода. При этом не забывайте отверстие пробирки направлять в сторону, где никого нет – «от людей».
Для получения водорода на экзамене вряд ли будет использоваться аппарат Киппа. Скорее, предложат пробирку с газоотводной трубкой или колбу, накрытую перевернутой воронкой. Желательно уточнить этот момент на консультации перед экзаменом и обговорить с учителем меры безопасности.
Водород можно получить и взаимодействием натрия, кальция с водой, но этот опыт не вполне безопасен (если взять слишком большой кусочек натрия, может произойти взрыв).
2Na + 2HOH = 2NaOH + H2↑
Билет № 13
Щелочи в свете представлений об электролитической диссоциации. Химические свойства щелочей: взаимодействие с кислотами, кислотными оксидами, солями (на примере гидроксида натрия или гидроксида кальция).
Щёлочи – это растворимые основания.
С точки зрения теории электролитической диссоциации основаниями являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов, т.е. основные гидроксиды:
Более строгая формулировка: отщепляющие в качестве анионов (отрицательных ионов) только гидроксид-ионы.
Растворы щелочей окрашивают индикатор фенолфталеин (сокращенно ф-ф) в малиновый цвет.
Лакмус окрашивают в синий, метилоранж – в желтый, но это в школьной лаборатории видно плохо, не дает возможности отличить от нейтрального раствора.
Щёлочи реагируют с кислотами с образованием соли и воды (реакция нейтрализации):
NaOH + HCl = NaCl + H2O
Щёлочи реагируют с кислотными оксидами с образованием соли и воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O (известковое тесто при неправильном хранении поглощает углекислый газ, образуется карбонат кальция)
Щелочи реагируют с растворами солей, если в результате реакции образуется осадок:
Например, при сливании с растворимыми солями меди (II) выпадает синий осадок гидроксида меди (II).
При нагревании солей аммония со щелочами выделяется газообразный аммиак:
Как можно установить присутствие водорода в пробирке?
Как можно установить присутствие водорода в пробирке?
Как горит чистый водород?
2H2 + O2 = 2H2O реакция будет с таким хлопком или вспышкой.
Четыре пробирки наполнены кислородом, водородом, углекислым газом и воздухом?
Четыре пробирки наполнены кислородом, водородом, углекислым газом и воздухом.
Как узнать, какой газ находится в каждой пробирке?
Заранее большое спасибо!
Что вы наблюдали при поднесении?
Что вы наблюдали при поднесении.
Что вы наблюдали при поднесении пробирки с водородом к пламени?
Какие вещества образуются в результате горения водорода?
Напишите уравнение этой реакции.
Массовые доли водорода и кислорода в оксиде водорода равны соответственно 11 и 89%?
Массовые доли водорода и кислорода в оксиде водорода равны соответственно 11 и 89%.
Установите простейшую форму этого оксида.
Как можно доказать, что в составе соляной кислоты присутствует водород?
Как можно доказать, что в составе соляной кислоты присутствует водород?
Сахар нефть водород они все чистые вещества?
Сахар нефть водород они все чистые вещества?
Присутствие ионов водорода можно обнаружить с помощью?
Присутствие ионов водорода можно обнаружить с помощью.
Присутствие ионов водорода можно обнаружить с помощью?
Присутствие ионов водорода можно обнаружить с помощью.
С водородом в присутствии катализатора реагирует : а)этилен б)этанол в)этан г)ацетальдегид?
С водородом в присутствии катализатора реагирует : а)этилен б)этанол в)этан г)ацетальдегид.
Напишите пожалуйста уравнение реакции : взаимодействие глюкозы с водородом в присутствии катализатора?
Напишите пожалуйста уравнение реакции : взаимодействие глюкозы с водородом в присутствии катализатора?
От васспрашивает Объема. Любой газ в нормальных условиях равна 22. 4л.
S + H2O = So2 + H Вроде бы так.
В первом будет 3)верны оба суждения Во втором : 1)Б 2)В 3)А.
Водород, кислород
♠ Техника безопасности
Водород горюч и в смеси с кислородом или воздухом образует взрывоопасную смесь. Все опыты с водородом разрешается проводить только в присутствии преподавателя, в очках или маске.
Если прибор, заполненный водородом, необходимо нагреть или поджечь водород на выходе из него, следует до начала нагревания вытеснить из прибора весь воздух водородом, затем проверить водород на чистоту.
Проверка водорода на чистоту. Для этого надо приготовить две маленькие пробирки. Надеть на газоотводную трубку прибора сухую пробирку, примерно через 5 секунд медленно снять ее, закрыв отверстие пробирки большим пальцем, и поставить на ее место вторую пробирку. Держа пробирку с водородом отверстием вниз, поднести ее к пламени зажженной горелки. Отнять палец и, чуть наклонив, быстро внести отверстие пробирки в пламя горелки. Следующую пробу проводят со второй пробиркой. * Почему? Проверку проводят до тех пор, пока проба водорода не будет загораться почти без звука.
Сбор водорода и его проверка на чистоту:
Только убедившись в чистоте выделяющегося водорода, можно поджечь его на выходе из прибора или начать нагревание прибора.
♣ Сборка прибора
Планирование. Готовясь собирать прибор, продумайте, какие узлы Вам понадобятся. Например: узел получения хлора; реакционная трубка; узел осушки и т. п. Прибор должен занимать как можно меньше места. Постарайтесь закрепить все детали на одном штативе, вот как здесь:
Нерационально сначала собирать прибор, а потом разбирать его, чтобы поместить внутрь реагенты. Если нет причин делать иначе, помещайте вещества сразу в нужное место.
Соединение узлов. Резиновые шланги и пробки, применяемые для соединения узлов и изоляции, могут подвергаться воздействию агрессивных сред (хлор и т. п.). Старая резина может пропускать газы, особенно водород. Поэтому надо использовать минимальные отрезки резиновых шлангов и стараться соединять части прибора «стык в стык».
Края всех стеклянных трубок должны быть оплавлены. * Как это делается? Чтобы облегчить надевание тугого шланга на стеклянную трубку, смочите ее каплей воды или глицерина. * Всегда ли все равно, чем смачивать?
Резиновые пробки, как и шланги, присоединяют, не вдавливая, а вкручивая. Избегайте нажимать на тонкие части стеклянной посуды.
Соединения на шлифах. Шлифы – это притертые стеклянные соединения. Шлиф с внешней поверхности трубки называется керн, внутренний шлиф – муфта. Соединять их следует, вставляя керн в муфту круговым движением. Шлифы обязательно надо смазывать. При работе с пониженным давлением пользуются вакуумной смазкой. Не нужно наносить много смазки: достаточно нанести тонкую полоску на керн; когда Вы соедините шлифы круговым движением, она размажется по всей поверхности. Перед соединением рекомендуется слегка обогреть шлифы горячим воздухом над горелкой.
Шлифы могут быть не только коническими. * Какие еще виды шлифов Вы встречали в лаборатории?
При работе с агрессивными газами или легколетучими жидкостями при атмосферном давлении в качестве смазки применяют фосфорную кислоту, при работе с неагрессивными соединениями без нагревания – вазелиновое масло или глицерин.
Закрепление прибора на штативах. Между металлической лапкой и стеклянной посудой, закрепляемой в штативе, надо поместить резиновую или термостойкую прокладку. * В каких случаях резиновая прокладка не годится? Сначала лапку с посудой зажимают рукой – плотно, но без усилия; потом закручивают винт лапки.
Обязательно должны быть закреплены колбы, реакционные трубки. Пример закрепления прибора:
Нет смысла располагать прибор четко «слева направо» и «строго по прямой». Расположение следует согласовывать с соседями (не помещать узел охлаждения рядом с горелкой соседа и т. п.). Чтобы прибор был компактен и занимал один штатив, изогните соединяющие резиновые трубки или используйте изогнутые стеклянные трубки (если это возможно).
Проверка на герметичность. Если пузырьки газа проходят через две промывалки с разной скоростью или не проходят совсем, это говорит о негерметичности прибора. Необходимо проверить соединения и пробки заново!
Когда промывалок в реакционном приборе нет, нужно закрыть выход прибора. Если прибор герметичен, то жидкость, находящаяся в колбе Вюрца, начнет быстро подниматься по воронке с длинной трубкой. Если же нет, можно найти место утечки, поочередно зажимая соединения частей прибора.
Проверка на герметичность:
Проверка на герметичность обязательна при работе с водородом и СО!
Занятие 2.
Демонстрационный эксперимент
♥ Опыты
1. Получение водорода действием металла на кислоту и изучение свойств водорода
В пробирку или небольшую колбу Вюрца поместить гранулы цинка.
Прилить через воронку с длинной трубкой 20% раствор H2SO4 (* почему именно такая концентрация?) и пропустить выделяющийся газ через реакционную трубку из тугоплавкого стекла с 0,5 г оксида металла (например, меди (II)).
Помещение оксида металла в реакционную трубку:
Выходное отверстие реакционной трубки должно быть закрыто согнутой стеклянной трубочкой, сужающейся на конце, для отвода непрореагировавшего водорода (рис. 11). В эту трубочку необходимо поместить медную спираль. * Зачем?
Рис. 11. Газоотводная трубка
Внешний вид прибора:
Прилить через воронку с длинной трубкой несколько капель раствора CuSO4. * Что изменилось и почему?
Проверить прибор на герметичность. * Как это сделать? Добиться герметичности подгонкой соединений или заменой узлов.
Проверить водород на чистоту. * Почему вначале выходящий из трубки водород не является чистым? Дождавшись, когда водород станет чистым, поджечь его на выходе.
Поместить над пламенем водорода холодную стеклянную воронку. * Объяснить наблюдения.
Прогреть реакционную трубку горелкой по всей длине, затем сильно нагреть ту часть трубки, где лежит оксид металла. Фото В.В. Загорского:
Если пламя погаснет (* почему это может произойти?), прекратить нагревание. Вновь поджечь водород можно после новой проверки на чистоту.
Если на стенках реакционной трубки оседает вода (* почему это может произойти?), удалить ее нагреванием.
Когда реакция закончится (* как это определить?), охладить прибор в токе водорода. * Почему нельзя сразу разбирать прибор?
** Оксиды каких металлов можно восстановить водородом? Дайте общий ответ.
2. Получение водорода
А) Действие металла на щелочь
В пробирку поместить 1-2 гранулы алюминия и 1-2 мл 40% раствора NaOH. Если реакция вначале идет медленно (* почему?), подогреть пробирку горячей водой. * Объяснить динамику реакции. Почему скорость реакции со временем возрастает?


Б) Действие металла на воду
Заполнить пробирку объемом 10-15 мл до краев водой. Закрыть отверстие большим пальцем, опрокинуть пробирку в кристаллизатор с водой и в таком положении закрепить в лапке штатива. Взять пинцетом или щипцами кусочек кальция и быстро подвести его под пробирку.
Убедиться в том, что в пробирке собран водород. * Как это сделать?
В) Действие кремния на щелочь
Поместить в пробирку небольшой кусочек кремния и прилить 40% раствор NaOH. * Как ускорить эту реакцию?
** Какой процесс лежит в основе методов получения водорода в лаборатории?
3. Получение кислорода
Наполнить несколько (* сколько? – см. опыт 4) баночек кислородом из кислородной подушки. Для этого нужно налить в баночку до краев воду, закрыть стеклянной пластинкой, перевернуть и погрузить в кристаллизатор с водой. Опустить газоотводную трубку подушки в кристаллизатор и, открыв кран, отрегулировать скорость подачи кислорода (чтобы можно было легко считать пузырьки газа). Подвести газоотводную трубку под отверстие баночки. Когда баночка будет почти наполнена кислородом, закрыть ее под водой пластинкой и вынуть.
* Какими еще способами получают кислород в лаборатории?
** Какой процесс лежит в основе этих способов?
4. Изучение свойств кислорода
А) Поместить немного серы в железную ложечку, поджечь серу и внести ее в баночку с кислородом. После прекращения горения серы влить в баночку несколько капель индикатора (на фото справа). * Какие индикаторы можно использовать? * Как меняется характер горения веществ при внесении их в кислород? Почему?


Б) Скрутить в спираль железную проволоку, вставить в нее спичку. Взять проволоку щипцами, поджечь спичку и внести проволоку в баночку с кислородом. * Горит ли железо на воздухе? Если да, то какие для этого нужны условия?
** Какие химические свойства характерны для кислорода?
5. Свойства пероксида водорода
А) Налить в пробирку около 1 мл 10% раствора Н2О2. Всыпать немного порошка MnO2. * Какую роль играет MnO2? Доказать, что за газ выделяется. * Как это сделать?
Б) Реакции в кислой среде
Прилить раствор Н2О2 к 1 мл раствора KMnO4, подкисленного 1 М раствором H2SO4.
Прилить по каплям раствор KI к 1 мл раствора Н2О2, подкисленного 1 М раствором H2SO4 (на фото слева). Экстрагировать образовавшийся иод (на фото справа). * Как это сделать? Какой растворитель для этого требуется?

Редкий случай: достигнута стехиометрия, иод выпал в осадок:
В) Реакции в щелочной среде
К 1 мл раствора соли хрома (III) (фото 1) прилить 20% раствор NaOH до растворения (фото 3) выпадающего вначале осадка (фото 2). Затем добавить 1 мл 10% раствора Н2О2 (фото 4). При необходимости нагреть пробирку на водяной бане.
На фото 5 – в избытке пероксида образовалось перекисное соединение хрома (VI). На фото 6 — перекисное соединение при подкислении.
К 1 мл раствора Н2О2 добавить немного иодной воды и 1 М раствора аммиака.
** Какие химические свойства проявляет пероксид водорода?
♣ Методы сбора газов
* С какими методами сбора газов Вы познакомились?
Собирать газы вытеснением воздуха можно в двух вариантах (рис. 12). * Приведите примеры газов, которые собирают по первому и второму вариантам. Каким критерием Вы пользуетесь, определяя, как собирать газ?
Рис. 12. Сбор газа вытеснением воздуха
Как можно установить присутствие водорода в пробирке? Как горит чистый водород? Как горит смесь водорода и воздуха? Смесь каких газов
В 5:42 поступил вопрос в раздел ЕГЭ (школьный), который вызвал затруднения у обучающегося.
Вопрос вызвавший трудности
Ответ подготовленный экспертами Учись.Ru
Для того чтобы дать полноценный ответ, был привлечен специалист, который хорошо разбирается требуемой тематике «ЕГЭ (школьный)». Ваш вопрос звучал следующим образом: Как можно установить присутствие водорода в пробирке? Как горит чистый водород? Как горит смесь водорода и воздуха? Смесь каких газов
После проведенного совещания с другими специалистами нашего сервиса, мы склонны полагать, что правильный ответ на заданный вами вопрос будет звучать следующим образом:
НЕСКОЛЬКО СЛОВ ОБ АВТОРЕ ЭТОГО ОТВЕТА:
Работы, которые я готовлю для студентов, преподаватели всегда оценивают на отлично. Я занимаюсь написанием студенческих работ уже более 4-х лет. За это время, мне еще ни разу не возвращали выполненную работу на доработку! Если вы желаете заказать у меня помощь оставьте заявку на этом сайте. Ознакомиться с отзывами моих клиентов можно на этой странице.
ПОМОГАЕМ УЧИТЬСЯ НА ОТЛИЧНО!
Выполняем ученические работы любой сложности на заказ. Гарантируем низкие цены и высокое качество.
Деятельность компании в цифрах:
Зачтено оказывает услуги помощи студентам с 1999 года. За все время деятельности мы выполнили более 400 тысяч работ. Написанные нами работы все были успешно защищены и сданы. К настоящему моменту наши офисы работают в 40 городах.
Площадка Учись.Ru разработана специально для студентов и школьников. Здесь можно найти ответы на вопросы по гуманитарным, техническим, естественным, общественным, прикладным и прочим наукам. Если же ответ не удается найти, то можно задать свой вопрос экспертам. С нами сотрудничают преподаватели школ, колледжей, университетов, которые с радостью помогут вам. Помощь студентам и школьникам оказывается круглосуточно. С Учись.Ru обучение станет в несколько раз проще, так как здесь можно не только получить ответ на свой вопрос, но расширить свои знания изучая ответы экспертов по различным направлениям науки.
Класс: 8
Презентации к уроку
Место урока: 8 класс. Тема II: Кислород, водород, вода как растворитель.
Тип урока: практическая работа
Задачи:
Планируемые результаты обучения:
Оборудование:
Методы и приемы:
Ход урока
(курсивом описаны действия учеников и учителя, особенности методики урока; обычным шрифтом – речь учителя)
I. Организационный момент (1 мин.)
отметить наличие халатов у всех учеников, проверить свободны ли от сумок проходы, убраны ли волосы у девочек. На столах оставить только ручки, калькуляторы и тетради.
II. Активизация знаний, необходимых для выполнения практической работы (13 мин.)
Слайд 1:
На этом уроке мы получим водород в лабораторных условиях. Это газообразное вещество; является взрывоопасным, если загрязнено воздухом, и поэтому требует к себе повышенного внимания.
Ученики одновременно с обсуждением расписываются в журнале техники безопасности.
Слайд 2:

На предыдущем уроке была проведена подготовка учеников к данной практической работе (Презентация 1) и задано домашнее задание:
Слайд 3:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
Слайд 4:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
Просмотр двух видеороликов.
При проверке водорода на чистоту сжигают небольшой его объем (около 15 мл).
Возможный микровзрыв к травме привести не может.
Правило ТБ: пока нет убежденности, что газ из прибора выделяется чистый, держать отверстие газоотводной трубки подальше от пламени спиртовки.
Слайд 5:
Демонстрация результатов нарушений правил ТБ: пробирка с растресканным дном
Правило ТБ: нагревать пробирку необходимо в том месте, где находится твердое вещество, а не выше – где воздух. От неравномерного нагрева пробирка треснет.
пробирка со следами соляной кислоты в смеси с оксидом меди (II)
Правило ТБ: при зарядке автоматического прибора соляной кислотой нужно следить, чтобы не перелить кислоту (max 2 мл), иначе избыток от экзотермичности и бурного течения процесса попадет в газоотводную трубку.
III. Демонстрация эксперимента учителем (7 мин.)
Слайд 6
Слово учителя с элементами беседы
1. Взять ложкой-дозатором небольшое количество черного порошка оксида меди (II), поместить в пробирку, оставить в штативе для пробирок до проведения опыта по изучению восстановительных свойств водорода.
2. Закрепить автоматический прибор для получения газов в лапке штатива. Зарядить прибор исходными веществами: 4-5 гранул цинка поместить на резиновый кружок, через воронку прилить соляную кислоту так, чтобы ее слой над цинком был не более 2 мл. Прибор закрыть максимально герметично.
3. Для проверки газа на чистоту, мне приходится приготовить спиртовку заранее. Вы работаете вдвоем и зажжете спиртовку после того, как наберете газ в пробирку- приемник.
Правила ТБ: работа со спиртовкой
а) прежде чем зажечь спиртовку, нужно проверить плотно ли диск прилегает к отверстию резервуара (иначе искра может попасть в резервуар и весь объем спирта воспламенится)
б) зажигать только спичкой (нельзя использовать зажигалку, другую спиртовку)
в) спичку класть в лоток следует, убедившись, что она затушена (демонстрация нарушения правил ТБ – прожженный лоток)
г) чтобы погасить пламя, ее следует закрыть колпачком (задувать нельзя)
Выделяющийся водород собрать методом вытеснения воздуха, держа пробирку-приёмник вверх дном. Проверить газ на чистоту: зажать отверстие пробирки пальцем и поднести пробирку к пламени спиртовки, открыть ее.
4. Затем выделяющийся водород собрать методом вытеснения воды: набрать полную пробирку воды, перевернуть ее в кристаллизаторе и подвести к отверстию газоотводную трубку. Когда пробирка-приемник полностью заполнится водородом, зажать отверстие пальцем под водой. Убедиться в чистоте газа.
5. Закрепить пробирку с оксидом меди (II) в держателе.
Правила ТБ: закрепление пробирки в держателе
а) пробирку закрепляют в верхней третьей части ближе к отверстию
б) пробирка не должна выпадать, но проворачиваться (иначе при нагревании стекло расширяется и пробирка может лопнуть)
в) чтобы вынуть пробирку из держателя, нужно ослабить зажим.
Прогреть пробирку на пламени спиртовки 2-3 раза, далее нагревать ее в верхней части пламени, в том месте, где находится оксид меди (II). Внести газоотводную трубку с выделяющимся водородом.
После окончания опыта дать пробирке остыть, затем поставить в штатив для пробирок.
6. Потушить спиртовку, перекрыть зажимом выделение водорода.
Основное правило ТБ: работать уверенными руками!
IV. Выполнение практической работы, оформление результатов, уборка рабочего места (23 мин.)
Слайд 6
1. Ученики выполняют практическую работу самостоятельно. Учитель следит за правиль-ностью выполнения техники эксперимента и соблюдением правил ТБ.
2. Уборка рабочего места: после окончания опыта по изучению восстановительных свойств водорода:
1-й ученик: потушить спиртовку, дать пробирке-реактору остыть, затем поставить ее в штатив для пробирок.
2-й ученик: перекрыть выделение газа в автоматическом приборе, вынуть воронку, остатки цинка поместить на фильтровальную бумагу. Вынуть прибор из лапки штатива, слить отра-ботанный раствор в «СКЛЯНКУ ДЛЯ СЛИВА», сдать прибор учителю.
учитель: собирает лотки и кристаллизаторы с водой.
3. Демонстрационный опыт: изучение продукта реакции цинка с соляной киcлотой
Отработанный раствор слить в стакан и несколько капель с помощью стеклянной палочки перенести на стеклянную пластинку. Укрепить пластинку в тигельных щипцах и упарить раствор на пламени
4. Оформить результаты эксперимента: сформулировать и записать наблюдения, вывод (что узнали про газообразное вещество водород на практической работе), сдать тетрадь.
Проведение урока (Фото-фильм)
Использованные электронные пособия:
Оформление работы в тетради ученика:
Практическая работа 5: Получение водорода и изучение его свойств
1. Способ получения водорода – взаимодействие активных металлов с кислотами.
2. Приборы для получения и собирания водорода
Рис. Прибор для получения водорода – автоматический, который позволяет в любой момент остановить реакцию с помощью зажима (прибор Кирюшкина).
Собирание газа методом вытеснения воды – возможно, т.к. водород малорастворим в ней.
Рис. Собирание газа методом вытеснения воздуха – держа пробирку-приемник вверх дном, т.к.

3. Обнаружение водорода – проверка его на чистоту
4. Свойство водорода – активный восстановитель
Вывод:
Одним из способов получения водорода в лаборатории является взаимодействие цинка с разб. соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен, восстанавливает металлы из их оксидов.