чем повысить андрогены у женщин
Гиперандрогения у женщин
Лебедева Марина Юрьевна
Уровень андрогенов у женщин с симптомами гиперандрогении может находиться в пределах нормы. Поэтому по одному лишь анализу гормонов нельзя ставить диагноз и тем более строить стратегию лечения. О гиперандрогении свидетельствуют, прежде всего, симптомы, составляющие клиническую картину заболевания. Они делятся на три основных группы:
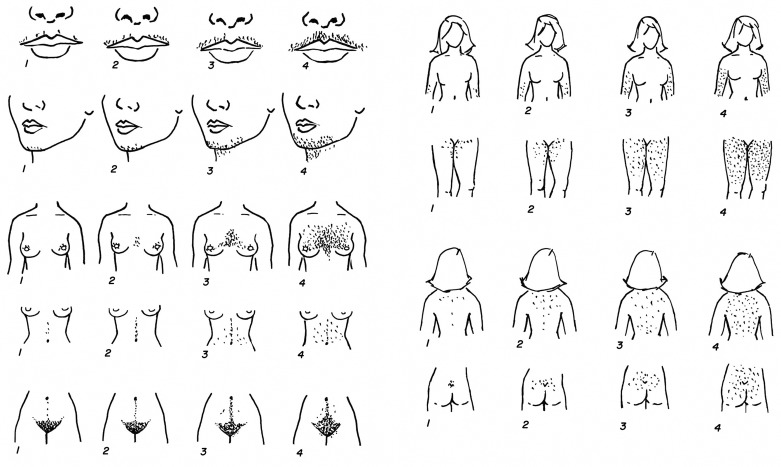
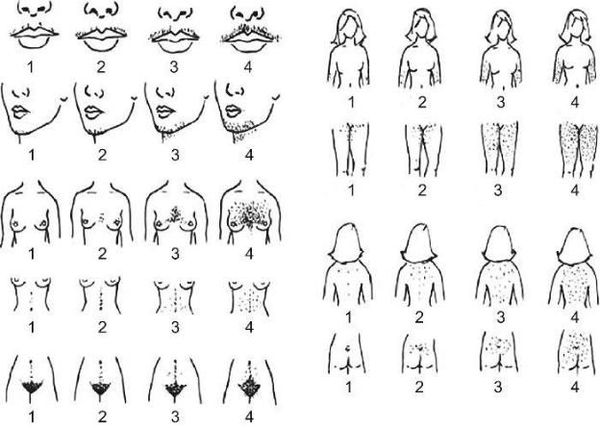
Внешние или косметические проявления заболевания проявляются как:
Гинекологические заболевания, возникающие на фоне гиперадрогении:
Нарушение обмена веществ при гиперандрогении:
Симптомы
До 20% пациенток гинекологических клиник имеют симптоматику этого заболевания. При этом прямой связи с уровнем мужских гормонов в крове не наблюдается. Андрогены могут быть как повышены, так и в норме. Причем чаще всего они не выходят за пределы нормы, а патологические состояния возникают по иным причинам. Проблема может заключаться в образовании тестостерона так называемых андрогенов-предшественников в тканях, состоящих из чувствительных к андрогенам клеток; увеличением его утилизации.
Один из самых распространенных симптомов это акне, даже при нормальной концентрации андрогенов. Проблематика заключается в неадекватной реакции сальных желез на мужские половые гормоны. Но это состояние нужно снимать антиандрогенными препаратами, не смотря на результаты анализов.
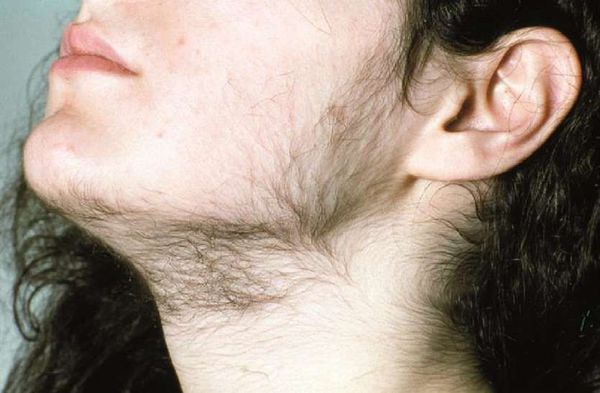
При гирсутизме примерно у половины пациенток уровень мужских половых гормонов повышен. И это становится причиной оволосения по мужскому типу. Но ряд зарубежных авторов считают, что к идиопатическому гирсутизму приводит увеличение продукции отдельными тканями дегидротестостерона (ДГЭА) значительно менее активного тестостерона. Исследования говорят о влиянии гормона ГСПГ, который связывает свободный тестостерон, содержащийся в крови, уменьшая его взаимодействие с клетками организма. Синтез этого агента происходит в печени и может ослабевать при нарушении ее функции. На него оказывают влияние эстрогенов и гормонов щитовидной железы. Их дефицит приводит также и к снижению уровня ГСПГ.
Расстройствам, связываемым с гиперандрогенией, часто сопутствует нарушение регулярности менструального цикла. При повышенных андрогенах у таких пациенток менструации могут и вовсе прекратиться до естественного наступления менопаузы. По той же причине может наступить ановуляция, сопровождающаяся снижением синтеза прогестерона и нарушением нормального гормонально фона. Прогрессирующий дисбаланс приводит к эстрогенной стимуляции эндометрия со снижением функции секреторной трансформации. А это в свою очередь повышает риск возникновения гиперплазии и других более серьезных заболеваний.
Осложнения
Одно из самых опасных последствий развития гиперандрогении у женщин – сахарный диабет II типа, при котором рецепторы клеток теряют чувствительность к инсулину. К сожалению, именно неправильная или несвоевременная диагностика первичного заболевания, опирающаяся только на анализы андрогенов, приводит к такому осложнению. При наличии симптомов врач должен назначать дифференциальную диагностику, включающий комплексный гормональный анализ, в котором исследуются не только мужские половые гормоны, но пролактин, ЛГ, ФСГ, ДГЭАС. Исследования проводятся по показаниям индивидуально, а не каждой пациентке. Например, при акне, чаще всего развивающемся при нормальном уровне андрогенов, комплексный анализ можно не делать, если глюкоза в норме или нет других проявлений, характерных для гиперандрогении.
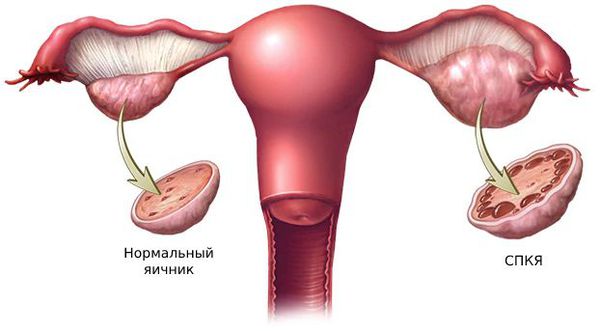
У пациенток с сиптомами гирсутизма очень часто (по некоторым данным до 90%) выявляют поликистоз яичников (ПКЯ). При этом андрогены повышены только у половины из них. Это дает повод считать, что у части пациенток наблюдается симптоматическая гиперандрогения.
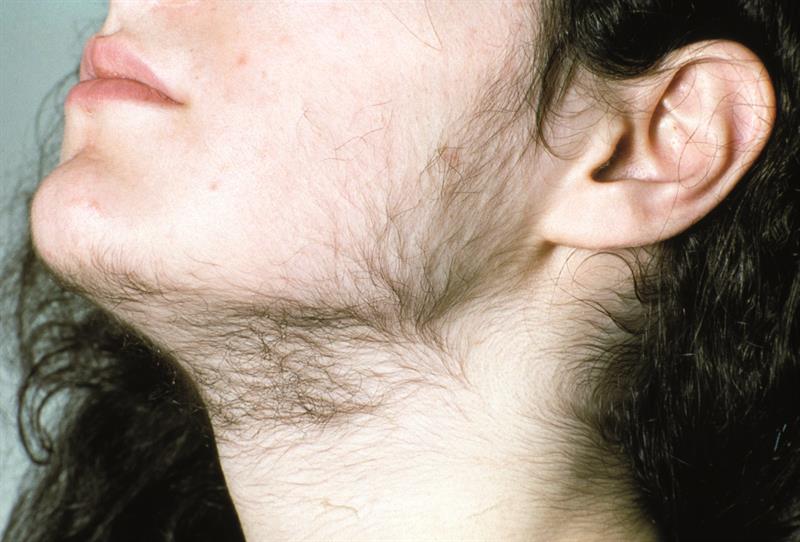
Гирсутизм у женщины
Женщины с выраженными симптомами гиперандрогении нуждаются в наблюдении и лечении этого заболевания, особенно если в планах есть беременность. Лечение таких пациенток проводят, прежде всего, путем медикаментозной стимуляции овуляции. Нарушение овуляции может привести к образованию кист яичников. Наличие кист яичников осложняет детородную функцию.
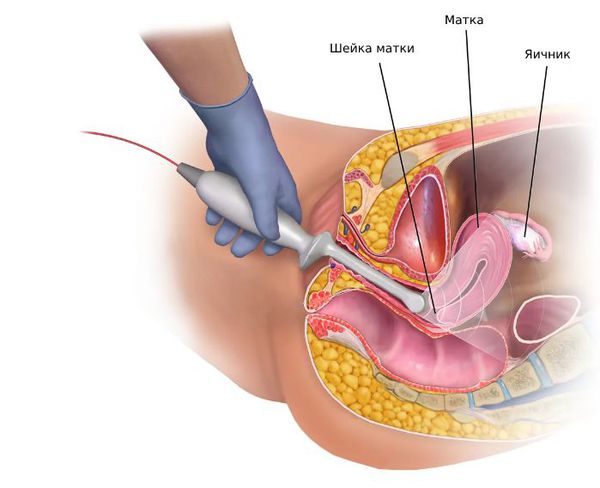
Поликистоз нередко сопровождается усилением выработки яичниками андрогенных гормонов. Если гиперпродукция не вызвана опухолевым генезом, то наблюдается вялотекущая прогрессия заболевания, которая может растянутся на несколько лет. Резкое проявление симптомов свидетельствует о возможном наличии опухолей, продуцирующих андрогены. Чаще всего это такие образования, как текома и лютеома. Уровень андрогенов при этом доходит до мужской нормы (свыше 200 нг/дл) и более. При наличие этих признаков необходимо произвести УЗИ яичников (компьютерную томографию). Обнаруженные опухоли подлежат удалению хирургическим путем. У пациенток с признаками гирсутизма такая картина встречается менее чем в одном случае из ста.
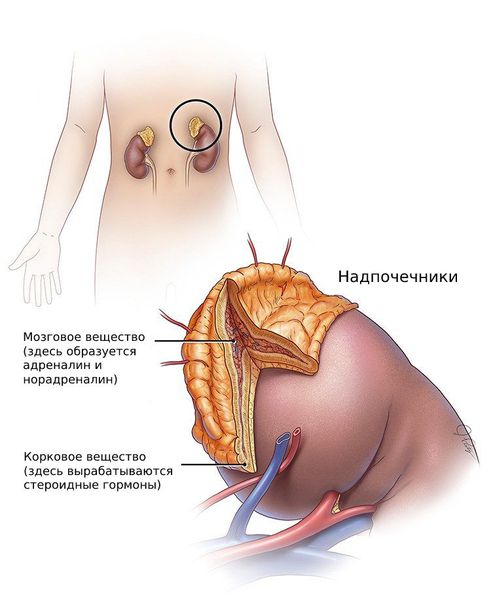
Гиперпродукция андрогенов у женщин может производиться надпочечниками. При неопухолевом генезе ее причина обусловлена недостаточной выработки кортикостероидов, что провоцирует усиление синтеза андрогенных гормонов корой надпочечников. Маркером подтверждения этого диагноза считается умеренное повышение уровня ДГЭАС.
Недостаток кортикостероидов при гиперандрогении надпочечникового генеза назначают компенсационную медикаментозную терапию (препараты, содержащие глюкокортикостероиды). Пациенткам с выраженными симптомами гирсутизма или с поликистозом яичников рекомендуется дополнительно назначать антиандрогенные препараты.
Синдром галактореи-аминореи в некоторых случаях сопровождается гиперандрогенией надпочечного генезиса. Но истинная причина дисбаланса кроется в повышенном пролактине. Для нормализации этого гормона назначаются такие ингибиторы, как бромкриптин и т.п.
Высокий уровень ДГАЭС, превышающий 800 мкг/дл, указывает на возможное наличие опухолей надпочечников, которые продуцируют андрогены. Для их диагностики назначают исследование МРТ или компьютерную томографию.
Лечение
Лечение гиперандрогении в большинстве случаев проводят антиандрогенными препаратами. Одним из главных препаратов для лечения является КОК с антиандрогенным эффектом- Джес, Ярина, Диане-35. Однако подбор препарата обследование и подготовку организма к приему лекарства должен осуществлять врач. Длительность курса зависит от симптоматики. Угревая сыпь и себорея преодолевается дольше, чем гирсутизм. Для закрепления результата препарат рекомендуется принимать непрерывно на протяжении всего курса, который может длиться до одного года, и продолжать лекарственную терапию еще 3-4 месяца после визуального улучшения.
Гиперандрогения и беременность
Препараты, содержащие антиандрогены, которые прописывают при лечении гиперандрогении, имеют выраженный контрацептический эффект. Поэтому пациенткам, желающим забеременеть, эти лекарства не назначают. Не каждая форма этого заболевания, хотя с ним связывают 30% случаев прерывания беременности в первый триместр, подлежит лечению в период вынашивания ребенка. Врач принимает во внимание историю предыдущих беременностей. Лечение назначается только в том случае, если существует риск выкидыша по причинам, связанных с гиперандрогенией. Но назначают только глюкокортикоидные препараты, которые через гипофиз воздействуют на снижение уровня андрогенных гормонов надпочечниками.
Что такое гиперандрогения? Причины возникновения, диагностику и методы лечения разберем в статье доктора Скатова Бориса Васильевича, уролога со стажем в 27 лет.
Определение болезни. Причины заболевания
Гиперандрогения — это состояние, при котором у женщины в крови значительно повышен уровень мужских половых гормонов (андрогенов): тестостерона, дигидротестостерона, андростендиона и других.
Распространённость
Причины
Симптомы гиперандрогении
Патогенез гиперандрогении
Андрогены — стероидные половые гормоны, которые вырабатываются из холестерина в коре надпочечников, а также в клетках фолликулов и соединительной ткани яичников.
К андрогенам относятся:
Роль андрогенов
В женском организме андрогены поддерживают гормональный баланс и после начала полового созревания инициируют рост волос на лобке и в подмышечных впадинах. Также они необходимы для выработки эстрогена и возникновения полового влечения.
Андрогены замедляют потерю кальция в костях и регулируют работу внутренних органов и систем: репродуктивной, почечной, мышечной и сердечной.
Гормональная регуляция происходит почти мгновенно с малым количеством активного вещества — гормона. Другая её особенность заключается в дистанцировании: гормон может вырабатываться в одной железе, а попадать в орган-мишень, находящийся в другой части организма.
В плазме крови андрогены взаимодействуют с глобулином, связывающим половые гормоны (ГСПГ). Он выполняет транспортную роль: вместе с ним андрогены доставляются с кровью в клетки органов-мишеней.
Избыток андрогенов
К избытку андрогенов могут приводить различные патологические механизмы:
Повышать уровень андрогенов могут и другие внешние факторы, например приём стероидов и гормональных препаратов. Интересно, что при всех гиперандрогенных состояниях, андрогены происходят более чем из одного источника. Так, при поликистозе яичников увеличен синтез тестостерона, но большая часть этого гормона образуется вне яичников — в надпочечниках.
Большую роль в развитии первичной гиперандрогении играют генетические факторы. Одной из причин синдрома поликистозных яичников (СПКЯ) является генетически предопределённый избыток лютеинизирующего гормона (ЛГ). ЛГ стимулирует образование мужских половых гормонов: тестостерона и андростендиона. Их чрезмерная выработка нарушает процесс развития фолликулов: они преждевременно перерождаются в жёлтое тело и в этой области образуются фолликулярные кисты.
Другая причина развития СПКЯ — генетически обусловленное нарушение выработки инсулина и развитие инсулинорезистентности, то есть недостаточный ответ тканей на его действие.
К гиперандрогении, как было сказано выше, может приводить врождённая гиперплазия коры надпочечников. Причина её развития — мутации генов, которые отвечают за синтез ферментов или транспортных белков, участвующих в выработке кортизола.
Классификация и стадии развития гиперандрогении
Согласно Международной классификации болезней (МКБ-10), гиперандрогения кодируется как Е.28.1 Избыток андрогенов. Выделяют истинную гиперандрогению и другие её формы.
Истинная гиперандрогения
Истинная гиперандрогения бывает яичниковой и надпочечниковой
Яичниковая гиперандрогения:
1. Синдром поликистозных яичников. Первичный СПКЯ (синдром Штейна — Левенталя) возникает при нарушении в системе гипоталамус-гипофиз-яичники. Вторичный СПКЯ развивается при эндокринной патологии, например на фоне сахарного диабета, заболеваний щитовидной железы или под воздействием внешних факторов: интоксикации, стресса, травмы и инфекции.
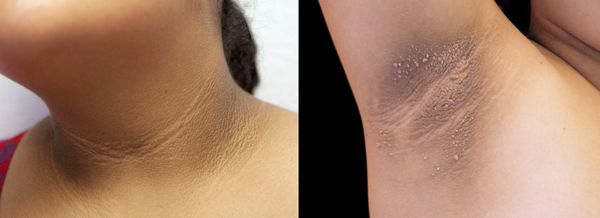
2. Стромальный текоматоз яичников (синдром Френкеля) — тяжёлая форма овариальной неопухолевой гиперандрогении. При заболевании разрастается соединительная ткань и возникает синдром HAIR-AN (высокий уровень андрогенов, инсулинорезистентности, ожирение и чёрный акантоз). Это редкая патология выявляется преимущественно в постменопаузе.
3. Андроген-продуцирующая опухоль яичников:
Надпочечниковая гиперандрогения:
Другие формы гиперадрогении
Осложнения гиперандрогении
Наиболее частые осложнения гиперандрогении: бесплодие, инсулинорезистентность и ожирение. Нарушение обмена липидов, сахарный диабет, сердечно-сосудистая патология возникают как следствие этих процессов.
Механизмы развития гиперандрогении и гиперинсулинемии до конца не изучены. Теоретически возможны три варианта взаимодействия: гиперандрогения вызывает гиперинсулинемию, гиперинсулинемия приводит к гиперандрогении и есть третий фактор, ответственный за оба феномена.
Предположение о том, что гиперандрогения вызывает гиперинсулинемию, основано на следующих фактах:
О том, что гиперинсулинемия вызывает гиперандрогению, свидетельствует следующее: инсулинорезистентность сохраняется у пациенток с удалёнными яичниками и при длительном приёме препаратов, подавляющих выработку андрогенов.
Диагностика гиперандрогении
Диагностика проводится эндокринологом или гинекологом-эндокринологом.
Этапы:
1. Опрос (сбор анамнеза). Врач беседует с пациенткой и выясняет следующие факты:
2. Осмотр. Доктор обращает внимание на следующие симптомы:
3. Лабораторные исследования:
Направление на анализы выписывает врач, так как часть из них нужно проводить в определённые дни менструального цикла.
4. Инструментальная диагностика:
Лечение гиперандрогении
Заболевание лечит врач-эндокринолог или гинеколог-эндокринолог.
Лечение поможет устранить симптомы и достичь основных целей:
Нормализация менструального цикла уменьшает риск гиперплазии эндометрия и рака тела матки, маточных кровотечений и постгеморрагической анемии.
В редких случаях выполняют операции на яичниках.
Комбинированные оральные контрацептивы (КОК) снижают уровень гонадотропинов, а значит и концентрацию андрогенов, которые производятся в яичниках. Содержащиеся в КОК эстрогены увеличивают синтез глобулина, связывающего половые гормоны и, следовательно, снижают уровень свободного тестостерона. Кроме того, прогестагены в составе КОК уменьшают синтез андрогенов в надпочечниках, подавляют фермент 5-альфа-редуктазу и блокируют связывание андрогенов с рецепторами.
Оптимальными будут КОК, содержащие прогестаген с антиандрогенным действием: ципротерон, хлормадинон, диеногест и дроспиренон. Также предпочтительны оральные контрацептивы с этинилэстрадиолом.
Наиболее известные КОК, применяемые для лечения гиперандрогении:
Прогестагены нормализуют менструальный цикл при циклическом или постоянном приёме. Однако есть гипотезы, что прогестерон сам обладает андрогеноподобным действием. Его, как правило, не назначают для лечения гиперандрогении, но применяют для нормализации второй фазы менструального цикла.
Блокаторы андрогенных рецепторов из–за выраженной тератогенности (влияния на внутриутробную закладку органов будущего ребёнка) беременным принимать запрещено.
Основные препараты из группы блокаторов андрогенных рецепторов:
Дозировку и режим приёма препаратов врач назначает индивидуально.
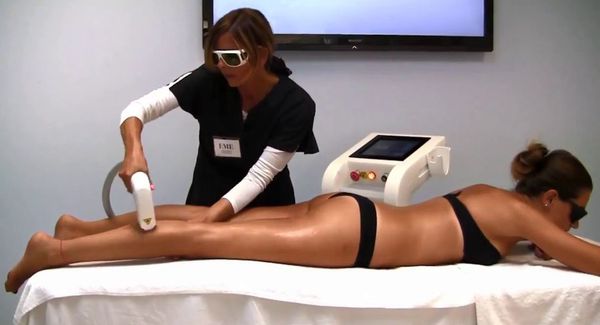
Способы удаления волос при гирсутизме
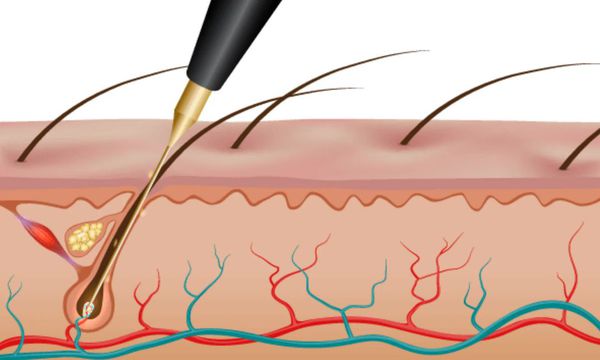
Существуют три вида электроэпиляции:
Побочные эффекты электроэпиляции: ожоги, раздражение кожи, редко — образование рубцов.
Лазерная эпиляция позволяет повредить волосяной фолликул, не разрушив окружающие его ткани. Процедуры нужно проводить многократно, но полностью избавиться от волос удаётся редко. В зависимости от источника светового излечения лазеры для удаления волос делятся на три группы:
Прогноз. Профилактика
Если своевременно обратиться к врачу и правильно подобрать лечение, то можно уменьшить неприятные симптомы и избежать серьёзных осложнений.
Результаты терапии следует оценивать через 3–6 месяцев, потому что антиандрогенные препараты действуют медленно: они постепенно накапливаются в организме и встраиваются в обмен веществ. Их приём требует адекватного дозирования, а также регулярной оценки результатов и возможных побочных действий.
Лечение позволяет избавиться от симптомов, поэтому для грамотной коррекции терапии пациентке необходимо регулярно посещать врача-эндокринолога
Профилактика:
Роль андрогенов у женщин: что мы знаем?
До последнего времени андрогены у женщин рассматривались лишь как причина различных метаболических и функциональных нарушений, однако их роль в женском организме по-прежнему до конца не изучена.

Продукция и транспорт андрогенов в женском организме
Гипофиз регулирует секрецию андрогенов у женщин посредством выработки лютеинизирующего гормона (ЛГ) и адренокортикотропного гормона (АКТГ). Главными андрогенами в сыворотке у женщин с нормальным менструальным циклом являются тестостерон и дигидротестостерон. Дегидроэпиандростерон-сульфат (ДГЭА-С), дегидроэпиандростерон (ДГЭА) и андростендион считаются прогормонами, поскольку лишь конверсия в тестостерон полностью проявляет их андрогенные свойства. ДГЭА производится главным образом в сетчатой зоне надпочечников, а также в тека-клетках яичников [11]. Тестостерон синтезируется следующим образом: 25% синтезируется в яичниках, 25% в надпочечниках, оставшиеся 50% производятся в результате периферической конверсии преимущественно в жировой ткани из предшественников андрогенов, которые вырабатываются обеими железами [12]. У здоровых женщин репродуктивного периода ежедневно производится 300 мкг тестостерона, что составляет приблизительно 5% от ежедневной продукции у мужчин [13]. В отличие от довольно резкого снижения выработки эстрогенов, что ассоциируется с менопаузой, уровни предшественников андрогенов и тестостерон уменьшаются с возрастом постепенно. Снижение уровня ДГЭА-С происходит в результате снижения функции надпочечников. Концентрации ДГЭА-С, который не связывается ни с каким белком и не изменяется в течение менструального цикла, составляют приблизительно 50% у женщин в возрасте 40–50 лет по сравнению с концентрацией, отмеченный у 20-летних женщин [14–16]. Аналогичная динамика также отмечена и в секреции тестостерона [17].
Известно, что андрогены являются предшественниками эстрогенов, которые образуются из тестостерона путем ароматизации в гранулезных и тека-клетках яичников, а также в периферических тканях.
В плазме тестостерон находится преимущественно в связанном состоянии, причем 66% связано с глобулином, связывающим половые гормоны (ГСПГ), 33% связано с альбумином и лишь 1% находится в несвязанном состоянии [17]. Некоторые заболевания (тиреотоксикоз, цирроз печени), а также прием эстрогенов в составе комбинированной оральной контрацепции (КОК) и заместительной гормональной терапии (ЗГТ) могут приводить к существенному увеличению ГСПГ и уменьшению свободной фракции тестостерона [18]. Следовательно, патология гипофиза, яичников, надпочечников, а также заболевания, сопровождающиеся дефицитом жировой ткани или увеличением ГСПГ, могут приводить к развитию андрогендефицитных состояний у женщин.
Конечными метаболитами тестостерона являются 5-альфа-дегидротестостерон и эстрадиол, количество которых в несколько раз меньше, чем тестостерона, из чего можно сделать вывод, что концентрация андрогенов у женщин в несколько раз превышает концентрацию эстрогенов. Таким образом, изучение роли андрогенов, а также заместительная терапия андрогендефицитных состояний у женщин, в том числе получающих ЗГТ эстрогенами и прогестинами с недостаточным эффектом, имеет под собой убедительное биологическое обоснование.
Влияние андрогенов на жировой и углеводный обмен
Одним из обсуждаемых побочных эффектов тестостерона является негативное влияние на липидный обмен, заключающееся в снижении липопротеидов высокой плотности (ЛПВП). Во многих исследованиях отмечено, что более высокие уровни общего тестостерона и индекс свободных андрогенов были прямо пропорционально связаны с общим холестерином, липопротеидами низкой плотности (ЛПНП) и триглицеридами, с одной стороны, и более низким уровнем ЛПВП — с другой [19–21]. Эта взаимосвязь наиболее четко прослеживалась у женщин с СПКЯ [22]. Исследования с пероральным применением метилтестостерона также показали значительное снижение ЛПВП при нормальном или пониженном уровне ЛПНП [23]. На протяжении многих лет этот факт являлся основным доводом противников применения андрогенов у женщин.
В то же время при применении парентеральных форм тестостерона (импланты, внутримышечные инъекции и трансдермальные препараты) не было отмечено снижения ЛПВП [24], а у женщин, получающих заместительную терапию эстрогенами, при добавлении тестостерона ундеканоата ежедневно и даже при достижении супрафизиологических концентраций тестостерона было отмечено значительное снижение общего холестерина и липопротеинов низкой плотности [25].
Bell R. и соавт. обследовали 587 женщин в возрасте от 18 до 75 лет, не предъявлявших никаких жалоб. Не было выявлено статистически значимой взаимосвязи между концентрацией эндогенного тестостерона, его надпочечниковых предшественников и уровнем ЛПВП, в то время как уровни ГСПГ были обратно пропорциональны уровням ЛПНП и триглицеридов [26].
Популяционное исследование, проведенное в Швеции, выявило, что женщины с низким уровнем андрогенов имели более высокую сердечно-сосудистую заболеваемость, в том числе и получавшие ЗГТ, даже если они и контролировали уровни липидов. При этом анализ, проведенный методом логистической регрессии, показал, что концентрация общего тестостерона была прямо пропорциональна ЛПВП и ЛПНП у всех женщин, в то время как уровень андростендиона положительно ассоциировался с ЛПВП и отрицательно с триглицеридами [27].
Интересно, что уровни ДГЭА-С, общего и свободного тестостерона и индекс свободных андрогенов обратно пропорционально коррелируют не только с индексом массы тела, но и с соотношением окружности талии к окружности бедер как у мужчин, так и у женщин [28, 29], однако в женской популяции эта закономерность была менее выражена [28].
В течение многих лет находили ассоциацию между гиперандрогенией и инсулинорезистентностью на примере женщин с СПКЯ [1], однако данные исследований показали, что терапия флутамидом и агонистами гонадотропного релизинг-гормона не улучшали чувствительность к инсулину у таких пациенток [5–7]. Противоречивые данные, которые были получены у женщин без СПКЯ в некоторых исследованиях, не подтвердили взаимосвязи тестостерона с инсулинорезистентностью [30, 31]. Удаление андрогенпродуцирующей опухоли у больной с выраженной гиперандрогенией через 9 месяцев привело к выраженному ухудшению периферической чувствительности к инсулину [32].
Андрогены и сердечно-сосудистая заболеваемость у женщин
Наиболее часто влияние андрогенов на кардиоваскулярный риск у исследователей ассоциируется с клинической моделью гиперандрогении при СПКЯ. У женщин с СПКЯ отмечено повышение уровня эндотелина-1, маркера вазопатии, свободного тестостерона, и инсулина. Назначение метформина, повышающего чувствительность периферических тканей к инсулину, в течение 6 месяцев способствовало значительному снижению уровней эндотелина-1, уменьшению гиперандрогении и гиперинсулинемии, а также улучшению утилизации глюкозы [33]. Метаанализ рандомизированых клинических исследований также показал, что терапия метформином у пациенток с СПКЯ приводила к снижению уровня андрогенов [34], что свидетельствует о первичной роли гиперинсулинемии в увеличении секреции андрогенов у женщин.
Толщина intima-media сонных артерий, определяемая с помощью ультрасонографии, — один из наиболее популярных маркеров, используемых исследователями для определения выраженности атеросклероза [35]. Большое число публикаций, сфокусированных на измерении толщины intima-media и определении уровней андрогенов, лишний раз это подтверждает. Bernini и соавт. обследовали 44 пациентки с физиологической менопаузой. Исследовались уровни общего и свободного тестостерона, андростендиона, измерялась толщина intima-media сонных артерий. Была отмечена обратная корреляция между уровнем андрогенов и толщиной intima-media — признаком, наиболее отражающим атеросклеротические изменения сосудов: у женщин с наименьшей толщиной intima-media уровни андрогенов находились в верхней трети нормального диапазона, а с наибольшей — в нижней четверти. На основании проведенного исследования авторы пришли к выводу, что андрогены могут оказывать благоприятное воздействие на стенку сонных артерий у женщин в постменопаузе [36]. К аналогичному выводу в своих исследованиях пришли и другие авторы [37–39].
Hak и соавт. исследовали соотношения уровней общего и биодоступного тестостерона и толщины intima-media брюшного отдела аорты у мужчин и женщин. Если у мужчин прослеживалась четкая обратная корреляция между уровнями общего и свободного тестостерона, то у женщин уровни этих андрогенов положительно коррелировали с аортальным атеросклерозом, но эта корреляция становилась статистически незначимой после учета других факторов сердечно-сосудистого риска [40].
Важным фактором в развитии серьезных сердечно-сосудистых осложнений является ангиоспазм. Worboys S. и соавт. исследовали эффекты парентеральной терапии тестостероном у женщин, получающих ЗГТ эстрогенами и прогестинами. Было обследовано 33 женщины в постменопаузе, получающие ЗГТ, имплантами с тестостероном (50 мг) длительностью более 6 мес. Контрольную группу составили 15 женщин, не получающих никакой терапии. При помощи УЗИ исследовались диаметр плечевой артерии, реактивная гиперемия (эндотелий-зависимая вазодилятация) и действие нитроглицерина (эндотелийнезависимая вазодилятация). В основной группе отмечалось повышение уровней тестостерона, что ассоциировалось с увеличением на 42% эндотелийзависимой вазодилятации. В контрольной группе не было отмечено никаких изменений. Похожие данные были получены в отношении эндотелийнезависимой вазодилятации. Авторы пришли к выводу, что парентеральная терапия тестостероном у женщин в постменопаузе, длительно получающих ЗГТ, улучшает как эндотелийзависимую, так и эндотелийнезависимую вазодилятацию плечевой артерии [42].
Влияние андрогенов на костно-мышечную систему у женщин
В ряде исследований было показано положительное влияние эндогенных андрогенов на минеральную плотность костной ткани (МПКТ) у женщин в постменопаузе. E. C. Tok et al. обследовали 178 женщин в постменопаузе, никогда не получавших ЗГТ [43]. Исследовались уровни андрогенов (ДГЭАС, андростендиона и свободного тестостерона) и их корреляция с МПКТ, измеренной методом двухэнергетической рентгеновской абсорбциометрии. Было отмечено, что уровни ДГЭАС и свободного тестостерона были положительно связаны с МПКТ поясничного отдела позвоночника и шейки бедра. При этом анализ данных методом линейной регрессии показал различный эффект андрогенов на костную ткань. Так, свободный тестостерон был независимо связан с минеральной плотностью поясничного отдела позвоночника (трабекулярная костная ткань), в то время как ДГЭАС — с минеральной плотностью шейки бедра (кортикальная костная ткань). По мнению авторов, различные андрогены по-разному влияют на различные типы костной ткани. S. R. Davis et al. в своем исследовании показали, что среди двух групп женщин в постменопаузе, получавших ЗГТ эстрогенами и эстрогенами в сочетании с тестостероном, МПКТ была достоверно выше во 2-й группе [44].
У женщин с андрогенным дефицитом, ассоциированным с ВИЧ-инфекцией, чаще, чем в общей популяции, развивается остеопороз и повышается риск переломов. В исследовании S. Dolan et al. было отмечено, что риск остеопении и остеопороза у таких пациенток ассоциировался с низким уровнем свободного тестостерона [45].
Влияние андрогенов на кроветворение
Эффекты тестостерона на эритропоэтин были отмечены еще в 60-е годы 20 века [46]. L. Ferrucci at al. при обследовании 905 пациентов старше 65 лет (критериями исключения являлись онкозаболевания, хроническая почечная недостаточность и прием препаратов, влияющих на концентрацию гемоглобина) выявили, что уровень гемоглобина коррелировал с уровнем свободного тестостерона как у мужчин, так и у женщин, кроме того, было отмечено, что при низком уровне тестостерона трехлетний риск развития анемии был выше, чем при нормальном уровне (у женщин в 4,1, а у мужчин в 7,8 раза) [47]. Другое исследование у женщин с анемией, ассоциированной с ВИЧ-инфекцией, показало аналогичную закономерность [48]. У женщин с СПКЯ, получающих антиандрогенную терапию, также была выявлена четкая позитивная ассоциация между концентрацией свободного тестостерона и уровнями гемоглобина и гематокрита [49].
Причины развития андрогендефицитных состояний у женщин
Дефицит андрогенов у женщин характеризуется снижением либидо, ощущения благополучия, депрессией, снижением мышечной массы и длительной беспричинной усталостью в сочетании с низким уровнем общего и свободного тестостерона при нормальном уровне эстрогенов [50]. Среди причин дефицита андрогенов выделяют яичниковые, эндокринные, хронические заболевания и медикаментозные [18, 50] (табл.).
Лабораторным критерием андрогенного дефицита у женщин является концентрация общего тестостерона в нижней квартили или ниже нижней границы нормального диапазона [50].
Эффекты андрогензаместительной терапии
Терапия тестостероном у женщин впервые была использована в 1936 г. с целью облегчения вазомоторных симптомов [51]. В настоящее время тестостерон при различных заболеваниях и состояниях у женщин применяется как off-label терапия во многих странах. Новая эра началась с 2006 г., когда применение пластыря, содержащего 300 мкг тестостерона, было официально одобрено Европейским медицинским агентством для лечения сексуальной дисфункции у женщин после овариоэктомии [52]. Тестостерон может применяться как в виде добавления к традиционной ЗГТ [27, 53], так и в виде монотерапии [54]. В рандомизированных плацебо-контролируемых исследованиях было показано, что трансдермальная монотерапия тестостероном в физиологической дозе 300 мкг дважды в неделю в течение 18 месяцев у женщин с андрогенным дефицитом, вызванным как гипопитуитаризмом, так и ВИЧ-инфекцией, приводила к достоверному увеличению МПКТ, мышечной массы и силы, а также улучшала показатели индексов депрессии и сексуальной функции у таких пациенток. При этом показатели жировой массы не изменялись, а побочные эффекты были минимальны [55–57]. Также было отмечено, что трансдермальная терапия тестостероном у женщин с андрогенным дефицитом, вызванным ВИЧ-ассоциированным синдромом потери массы тела, не нарушала чувствительность к инсулину, общую массу жировой ткани, регионарное распределение подкожно-жировой клетчатки и не влияла на маркеры воспаления и тромболизиса [58]. Кроме того, гель с тестостероном, наносимый на переднюю брюшную стенку, приводил к уменьшению абдоминальной подкожно-жировой клетчатки и уменьшению общей массы тела у женщин в постменопаузе [59]. Mестное применение крема с андрогенами было эффективно в отношении атрофического вагинита и диспареунии у пациенток в постменопаузе [60, 61].
Сочетание тестостерона с традиционной ЗГТ
Одним из наиболее часто применяющихся у женщин в США эстроген-андрогенным препаратом является Estratest, содержащий конъюгированные эквинные эстрогены и метилтестостерон. Как показали данные WHI, конъюгированные эстрогены не являются препаратом выбора для ЗГТ ввиду относительного увеличения риска рака молочной железы и сердечно-сосудистых осложнений у женщин старшей возрастной группы. Следовательно, оптимальный препарат для заместительной эстроген-гестагенной терапии должен соответствовать критериям безопасности в отношении молочных желез, эндометрия, не иметь негативного влияния на липидный и углеводный обмен, не повышать риск сердечно-сосудистых осложнений и положительно влиять на метаболизм костной ткани.
Из лекарственных средств, содержащих нативные половые гормоны, препаратом выбора является Фемостон, используемый для заместительной гормональной терапии в пери- и постменопаузе и единственный на современном рынке, выпускающийся в трех дозировках: 1/5, 1/10 и 2/10. Фемостон представляет собой комбинированный препарат, в состав которого входят 17-бета-эстрадиол — натуральный эстроген — и дидрогестерон — чистый аналог природного прогестерона, не теряющий своей активности при пероральном введении.
Применение дидрогестерона в сочетании с 17-бета-эстрадиолом усиливает защитный эффект эстрогенов на костную ткань. Если эстрогены действуют в направлении снижения костной резорбции, то исследования, проведенные in vitro, позволяют предположить, что дидрогестерон может способствовать костеобразованию [62]. Кроме того, дидрогестерон не обладает побочными гормональными эффектами и не оказывает отрицательного влияния на свертывающую систему крови, углеводный и липидный обмен [63]. Результаты проведенных клинических исследований Фемостона показали его высокую эффективность для лечения климактерических расстройств у женщин в перименопаузе, безопасность и хорошую переносимость, приемлемость и удобство в применении. Препарат способствует снижению атерогенного потенциала крови, в связи с чем может оказывать реальное профилактическое действие на частоту развития сердечно-сосудистых заболеваний. Комбинация 17-бета-эстрадиола с дидрогестероном лучше влияет на липидный профиль, чем некоторые другие схемы ЗГТ. В двойном слепом исследовании проводилось сравнительное изучение влияния двух вариантов ЗГТ: Фемостон 1/5 и конъюгированные конские эстрогены внутрь (0,625 мг) + норгестрел (0,15 мг). Оба варианта одинаково положительно влияли на уровень ЛПНП (снижение на 7% за 6 мес), но по влиянию на уровень ЛПВП Фемостон 1/5 оказался значительно эффективнее (увеличение на 8,6% и снижение на 3,5% соответственно; p
С. Ю. Калинченко, доктор медицинских наук, профессор
С. С. Апетов, кандидат медицинских наук