чем полоскать горло при лучевой терапии гортани
Лечение местных лучевых повреждений
Местные лучевые повреждения, развивающиеся преимущественно при лучевой терапии злокачественных опухолей, отличаются торпидностью к лечению различными медикаментозными средствами. Лучевые повреждения покровных тканей (кожи, слизистых) и внутренних органов
Местные лучевые повреждения, развивающиеся преимущественно при лучевой терапии злокачественных опухолей, отличаются торпидностью к лечению различными медикаментозными средствами. Лучевые повреждения покровных тканей (кожи, слизистых) и внутренних органов, как следствие воздействия ионизирующего излучения в суммарной очаговой дозе 60—70 Гр., проявляются в виде хронических эпителиитов и дерматитов, с прогрессированием их в лучевые язвы кожи, лучевые проктиты, циститы и т. п. В патогенезе таких повреждений, наряду с нарушением микроциркуляции, ведущее значение играет прямое воздействие излучения на клетки и подавление репаративных процессов. В дальнейшем на передний план выходят присоединение инфекции поврежденных тканей и усугубление негативных процессов заживления поврежденных тканей [1]. Вот почему в комплекс медикаментозных средств при лечении местных лучевых повреждений включаются вещества, воздействие которых направлено на улучшение тканевой микроциркуляции, повышение репараторных процессов и подавление инфекционного процесса. Для лечения местных лучевых повреждений апробированы практически все известные медикаментозные средства, удовлетворяющие перечисленным требованиям. Низкая терапевтическая эффективность имеющихся средств явилась основанием для поиска новых методов лечения. В отделении лечения лучевых повреждений МРНЦ РАМН ежегодно проходит лечение значительное число больных с лучевыми язвами конечностей и других областей тела, лучевыми повреждениями кишечника, мочевого пузыря и др. Основным компонентом местного лечения является препарат димексид (диметилсульфоксид, или ДМСО), применяющийся в виде перевязок раствора 5—10% или мази 10%. Это базовое лечение, назначаемое с учетом конкретных особенностей каждого больного, может дополняться назначением других антисептиков (диоксидин, хлоргексидин и др.), протеолитических ферментов, средств, стимулирующих репараторные процессы (куриозин, витаминизированные масла и др.). Разработанные схемы местного и общего лечения позволяют добиться благоприятных результатов у 57% пациентов [1, 2].
С сентября 2002 г. мы исследовали терапевтическую эффективность препарата гепон для лечения больных местными лучевыми повреждениями (см. таблицу 1).
 |
| Таблица 1. Применение гепона при лечении местных лучевых повреждений. |
Лучевые язвы у больных развились после лучевой терапии злокачественных опухолей (рак кожи — 16 пациентов, рак молочной железы — шесть, саркомы — четыре). Суммарная очаговая доза (СОД) составляла 45—70 Гр. Лучевые проктиты явились следствием лучевой терапии рака шейки и тела матки (13), рака мочевого пузыря (3) и прямой кишки (2). Лучевые циститы также наблюдались после лучевой терапии рака шейки и тела матки (13) и рака мочевого пузыря (4). Пневмофиброз — это следствие лучевой терапии лимфогранулематоза (6) и рака молочной железы (5 больных).
При лечении лучевых язв гепон применялся на первом этапе (7—10 дней) в виде орошения язвы раствором. Гепон (0,002) растворяли перед употреблением в 5 мл стерильного физиологического раствора. Орошение полученным раствором 0,04% гепона производилось ежедневно. На втором этапе, по мере развития грануляции, применялась мазь 0,04% (10—18 дней). Результаты лечения лучевых язв гепоном сопоставлялись с динамикой течения раневого процесса у более 800 больных, которым терапию проводили с принятыми в отделении методами лечения, состоящими в местном применении раствора 10% димексида (аппликации или электрофорез), электрофореза протеолитических ферментов и гепарина, использовании мазей левомиколя, ируксола, куриозина и эплана.
Эффективность применения гепона оценивалась клинически по состоянию раневой поверхности (уменьшение экссудации, скорости развития грануляций и скорости эпителизации язвы по Л. Н. Поповой (см. таблицу 2)), исчисляемой по формуле:
СЗ= (S-St)/St х 100, где
СЗ — скорость заживления
S — площадь лучевой язвы (мм 2 перед началом лечения)
St — площадь язвы (мм 2 ) в день измерения
t — время в сутках от начала лечения
 |
| Таблица 2. Скорость заживления лучевых язв. |
Положительный терапевтический эффект использования гепона мы склонны связывать в первую очередь с благоприятным его действием на микрофлору, что способствовало снижению воспалительного процесса и его негативных последствий (отек окружающих тканей, нарушение микроциркуляции и т. п.). Кроме того, важным аспектом действия гепона является его иммуномоделирующее действие, проявляющееся в активизации секреторного иммуноглобулина, снижении уровня противовоспалительных цитокинов, активизации a-интерферона, снижении адгезивной функции клеток и их апоптоза, прекращении вирусной репликации и повышении резистентности организма к бактериальной флоре.
В настоящее время, когда ранозаживляющее действие гепона доказано, лечение больных лучевыми язвами начинается с применения гепона, а затем дополняется, по показаниям, другими лекарственными средствами. Лечение лучевых ректитов (18 больных) и лучевых циститов (17 больных) проводилось в виде ежедневных двукратных микроклизм или инстилляций водного раствора 0,04% в течение 12—18 дней. Результаты применения гепона также сравнивались с результатами «традиционного» лечения, практиковавшегося в отделении в течение последних 25—30 лет (микроклизмы димексида 5—10%, эмульсии синтозона, витаминизированных масел и т. п.). Внутриполостное введение гепона уменьшало интенсивность болей и геморрагий и сокращало продолжительность лечения с 28—36 до 15—23 дней. Применение гепона активировало показатели иммунитета и у этой группы больных.
Таким образом, иммуномодулятор гепон в лечении больных с местными лучевыми повреждениями (лучевые язвы, лучевые ректиты и циститы) проявил себя как эффективное медикаментозное средство, способствующее быстрому снижению выраженности воспалительного процесса в поврежденных облучением тканях и ускорению репараторных процессов в них.
Литература
М. С. Бардычев, доктор медицинских наук, профессор
Медицинский радиологический научный центр РАМН (г. Обнинск)
Алиментарные мукозиты онкологических больных: новые пути нутритивной поддержки
Мукозит — объединяющий термин для воспалительных (эритематозных и эрозивно-язвенных) поражений слизистой рта, глотки, пищевода и в целом желудочно-кишечного тракта (ЖКТ) в результате противоопухолевого лечения [1]. Мукозит существенно повышает расходы на лечение, так как увеличивает продолжительность госпитализации, потребность в нутритивной поддержке и медикаментах [2]. Он может привести к летальному исходу: косвенно — в результате тяжелой нутритивной недостаточности и ее осложнений, либо непосредственно — вследствие сепсиса.
Тяжелый мукозит, особенно при поздно начатом лечении, приводит к вторичному инфицированию, болевому синдрому, психоэмоциональным проблемам, анорексии, невозможности энтерального питания. Разрушение естественного слизистого барьера создает повышенный риск инфекции, как локальной, так и системной [3].
Мукозит чаще всего развивается на 7–10 день от начала химиотерапии, продолжаясь на фоне нейтропении до 2–3 недель. Инфекции, связанные с мукозитом, часто обусловлены бактериальной флорой ротовой полости (грамположительной) и кишечника (грамотрицательной и анаэробной), грибами рода Candida и герпес-вирусами [4].
Мукозит: определение, частота и последствия
Оральный мукозит — часто регистрируемое и потенциально опасное осложнение противоопухолевой терапии. Воспаление и изъязвление слизистой оболочки ротовой полости снижают способность к глотанию, приему пищи и питью, что приводит к анорексии и потере веса. Гастроинтестинальный мукозит может развиваться в ответ на системную химиотерапию или лучевую терапию и сопровождается такими симптомами, как понос, вздутие живота, недержание кала и боли в животе.
Данное терминологическое разделение мукозита на оральный или гастроинтестинальный в зависимости от его локализации длительно сохранялось в англоязычной литературе. Однако, по мере развития клинических рекомендаций по лечению мукозита, стало преобладать мнение об искусственности этого деления, так как ЖКТ — единая структура в эмбриологическом и функциональном отношении. Мукозит может встречаться на любом уровне ЖКТ, но с различными клиническими проявлениями, что обусловлено специфической структурой и функцией слизистой различных его отделов [5]. Впоследствии появилась новая терминология. «Алиментарный мукозит» стал предпочтительным термином, описывающим воспаление слизистой вследствие противоопухолевой терапии, в любой точке ЖКТ, от ротовой полости до ануса.
Получение корректных и сопоставимых данных об истинной частоте и распространенности мукозита является непростой исследовательской задачей. Это обусловлено существующим разнообразием групп пациентов (вид опухоли, ее локализация, стадия) и методов лечения (трансплантация, химиотерапия, лучевая терапия, комбинированные режимы). Только недавно мукозит стал самостоятельным объектом клинических исследований. Кроме того, методика оценки тяжести мукозита редко является стандартизованной, что мешает судить о качестве полученных данных [2, 6].
Частота выявления мукозита у пациентов с опухолями головы и шеи, получающих лучевую терапию, и у больных после трансплантации гемопоэтических стволовых клеток (ТГСК) варьирует от 85% до 100% и от 75% до 100% соответственно [3, 7]. Таким образом, хотя только 4% всех описанных мукозитов наблюдались у пациентов, перенесших трансплантацию [8], частота мукозита в данной группе больных может достигать 100%.
Вследствие существенных клинических последствий орального мукозита, его экономическое бремя также является значительным. Данные из США свидетельствуют об удвоении затрат на пациентов, перенесших противоопухолевую терапию, у которых развился мукозит, по сравнению с теми пациентами, у которых данное воспаление отсутствовало [9]. Специфические затраты при мукозите включают в себя: 1) отсроченное или прерванное лечение (в 35% химиотерапия у пациентов отсрочена и прекращена у 30%); 2) энтеральное питание (87% пациентов, получивших ТГСК, нуждаются в зондовом питании); 3) назначение медикаментов, включая антибиотикотерапию и опиоидные аналгетики (в последних нуждаются до 80% пациентов ТГСК); и, наконец, 4) удлинение сроков госпитализации (у больных с солидными опухолями, получающими миелосупрессивную терапию, возникновение мукозита удвоило количество дней госпитализации за один цикл) [2, 9].
Клиническая оценка мукозита
Как в научных исследованиях, так и в терапевтической практике оценочные шкалы мукозита должны быть объективными, комплексными, воспроизводимыми и стандартными. К сожалению, ни одна шкала не отвечает всем названным критериям и не принята единодушно всеми профессиональными сообществами онкологов. Тем не менее, их широкое использование в онкологии позволяет провести ретроспективное сравнение токсичности между различными исследованиями.
Клинические рекомендации по профилактике и лечению мукозита
Первые клинические рекомендации [6] по ведению алиментарного мукозита были изданы в 2004 году и основывались на обзоре результатов исследований 14 рабочих групп. В данных рекомендациях подчеркивалась нехватка качественных научных публикаций по проблеме мукозита, соответствующих требованиям доказательной медицины. В целом эти рекомендации более фокусировались на рутинном уходе за больными, чем на препаратах с доказанной эффективностью. Тем не менее, среди них был рекомендован цитопротектор амифостин (Этиол) для профилактики эзофагита у пациентов, получающих лучевую терапию при немелкоклеточном раке легкого. Никакие специальные виды нутритивной поддержки не были включены в указанный документ. Однако из 205 источников, использованных при его составлении, четыре публикации касались супплементации глютамином [10–13].
Обновленные клинические рекомендации были изданы в 2007 году [14]. Основные изменения касались: рекомендаций к применению фактора роста кератиноцитов-1 (KGF-1), Kepivance для профилактики орального мукозита у пациентов ТГСК и рекомендаций против системного (парентерального) использования глютамина [15].
Эти клинические рекомендации представляют собой большой шаг вперед в разработке проблемы мукозита. Однако только очень небольшое количество практикующих врачей слышали об этих клинических рекомендациях и лишь неутешительно низкий процент врачей стал их использовать в своей практике. Таким образом, на первый план в будущем выдвигаются обучающие программы для профессионалов по ведению алиментарного мукозита [8, 16].
Общепризнанными принципами профилактики мукозита являются: соблюдение оральной гигиены, санация кариозных зубов и проявлений периодонтита перед началом химиотерапии. Стандартные профилактические правила ухода за полостью рта включают чистку зубов специальной мягкой щеткой или даже тампоном (при агранулоцитозе), частые полоскания раствором пищевой соды, антисептиками и противомикробными препаратами. Важно не использовать в питании раздражающие продукты (кислые, горькие, соленые) и пищу, агрессивную термически и механически (леденцы, семечки, сухарики, мелкие косточки). Лечение мукозита также включает регулярное полоскание полости рта для удаления зубного налета и поддержания влажности слизистой. Для снятия боли могут использоваться анальгезирующие препараты (лидокаин и др.), при выраженной боли необходимы системные аналгетики, включая опиоиды. Лечение вторичных инфекций (бактериальных, грибковых, вирусных), осложняющих мукозит, проводится по общим принципам лечения инфекций у иммунокомпрометированных больных [4]. В отличие от вышеперечисленных терапевтических положений, клиническое питание и нутритивная поддержка больных, страдающих мукозитом, разработаны в гораздо меньшей степени.
Мукозит: роль нутритивной поддержки
Нутритивная поддержка пациентов со злокачественными опухолями тазовой области, получавших лучевую терапию. У пациентов со злокачественными опухолями области таза, получающих лучевую терапию и химиотерапию, тяжелая нутритивная недостаточность встречается нечасто, однако острый гастроинтестинальный мукозит является типичной проблемой. В недавнем обзоре результатов нутритивной поддержки пациентов, получавших лучевую терапию на область таза (n = 2?646), делается заключение о том, что диеты с низким содержанием жира, среднецепочечные триглицериды (Medium Chain Triglycerides, MCTs), пробиотики и элементные диеты заслуживают дальнейшего изучения [17]. Основной причиной ограничения блюд обычного рациона и даже полимерных питательных смесей для клинического питания больных с гастроинтестинальным мукозитом является недостаточность ферментативного гидролиза в тонкой кишке. Так называемые элементные диеты, содержащие основные питательные вещества в виде гидролизатов и мономерных продуктов, традиционно используемые при мальабсорбции самого различного генеза, все шире применяются при гастроинтестинальных мукозитах у онкологических больных. Результаты первоначальных исследований вкусовой привлекательности и переносимости данных продуктов [18, 19] были впечатляющими [19], хотя число пациентов, употреблявших элементную диету на фоне лечения, снизилось с 92% в первую неделю до 46% в пятую неделю [19].
Новые компоненты питания при лучевой и химиотерапии:глютамин и TGF-бета
Оба названных компонента направлены на снижение активности воспалительного процесса, составляющего патогенетическую сущность алиментарного мукозита. Роль глютамина в профилактике токсичности, вызванной химиолучевой терапией, продолжает изучаться [20]. Глютамин — условно незаменимая аминокислота со многими биологическими функциями. Помимо его роли в регуляции внутриклеточного редокс-потенциала (предшественник глютатиона), глютамин способен сократить выработку провоспалительных цитокинов и снизить интенсивность связанного с ними апоптоза. Цитотоксическая химиотерапия увеличивает потребность клеток в глютамине. В таблице суммируются недавние исследования перорального приема глютамина для профилактики мукозита при лечении различных онкологических заболеваний [10, 11, 21–29].
Более новый компонент клинического питания при мукозите — трансформирующий фактор роста бета-2 (Transforming Growth Factor beta-2, TGF-beta-2). Его натуральным источником является молочный белок казеин. TGF-бета (существующий в трех изоформах) может быть классифицирован и как цитокин, и как фактор роста. Он вовлечен в регуляцию множества процессов, включая контроль клеточного цикла и процесс репарации [30]. Питательные смеси, содержащие казеин и богатые TGF-бета, показали свою эффективность в индукции ремиссии при болезни Крона [31], возможно, за счет прямого противовоспалительного эффекта в отношении слизистой кишечника [32]. В исследованиях на животных рацион, обогащенный TGF-бета, был продемонстрирован как протективный в отношении воспаления тонкого кишечника [33, 34]. Уникальной питательной смесью для клинического питания больных с алиментарным мукозитом является сухая полимерная безглютеновая и безлактозная смесь Модулен IBD, cодержащая терапевтические концентрации TGF-бета. Технология изготовления смеси для энтерального клинического питания Модулен IBD позволила сохранить в ее составе этот естественный противовоспалительный фактор роста, содержащийся в непастеризованном женском и коровьем молоке. Терапевтическая эффективность TGF-бета в профилактике и лечении мукозита еще не полностью оценена в клинической практике. Научный поиск в этой области начат относительно недавно, однако в число стандартных показаний к применению питательной смеси с противовоспалительным эффектом Модулен IBD уже включена профилактика и/или оказание дополнительного лечебного эффекта при поражениях слизистых, вызванных противоопухолевой терапией (мукозитах).
Нутритивная поддержка при ТГСК у пациентов с высоким риском мукозита
Традиционно парентеральное питание было основным предметом исследований в этой области. Однако в последние годы интерес к данному виду нутритивной поддержки снизился из-за его значительных недостатков, включая риск инфекций, связанных с центральным венозным катетером, увеличением длительности госпитализации, а также финансовых затрат. Однако, несмотря на это, при мукозите IV степени по шкале ВОЗ парентеральное питание остается единственным средством нутритивной поддержки пациента и, таким образом, продолжает играть важную роль для предотвращения нутритивной недостаточности [35].
Наряду с этим, имеются исследования, доказывающие, что энтеральное питание является безопасным и эффективным методом питания после аллогенной трансплантации [36], хотя необходимы дальнейшие рандомизированные исследования в этой области. Возможно, ключевым моментом в использовании энтерального питания является выбор времени введения пищевого зонда и начала питания [37], так как после развития алиментарного мукозита установка пищевого зонда трудно переносима и неоправданно травматична. Другой возможный подход к расширению объема энтерального питания — это использование назоеюнального зонда с целью прекращения рвоты, вызванной питанием элементными смесями [38]. ЃЎ
По вопросам литературы обращайтесь в редакцию.
Е. В. Полевиченко, доктор медицинских наук, профессор
ГОУ ВПО «Ростовский государственный медицинский университет», Ростов-на-Дону
Радиотерапия головы и шеи: что нужно знать о глотании
Эта информация описывает проблемы с глотанием, которые могут быть вызваны радиотерапией головы и шеи. Она также описывает способы их предотвращения.
О нормальном глотании
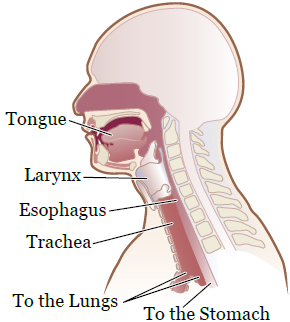
Рисунок 1. Органы, участвующие в глотании
Вам помогает глотать совместная работа множества мышц и нервов (см. рисунок 1).
Когда вы едите и пьете, пища и жидкость смешиваются с вашей слюной. Слюна размягчает и увлажняет пищу. Пережевывание позволяет измельчить пищу. При пережевывании пища и слюна образуют пищевой комок.
При глотании язык проталкивает пищу к задней стенке ротовой полости. После этого срабатывает рефлекс, и корень языка проталкивает пищу в пищевод. В этот момент гортань смыкается, чтобы предотвратить попадание пищи или жидкости в дыхательные пути (трахею). Затем пища проходит через пищевод и поступает в желудок.
Если мышцы ротовой полости или горла ослаблены, пища и жидкость могут застрять в пищеводе или попасть в дыхательные пути и в легкие. Обе эти ситуации могут быть опасны.
Попадание пищи или жидкости в дыхательные пути либо легкие называется аспирацией. Аспирация может привести к осложнениям, таким как пневмония (инфекция одного или обоих легких) и респираторные инфекции (инфекции, которые поражают нос, горло и дыхательные пути).
Как рак и радиотерапия могут повлиять на глотание
В зависимости от размера и локализации опухоли радиотерапия может ослабить мышцы и органы, участвующие в глотании. Они также могут работать не так хорошо, как до начала радиотерапии. Из-за этого вам может быть сложно есть и пить.
Радиотерапия может служить причиной:
Эти симптомы обычно появляются через 1-2 недели после начала радиотерапии. Во время лечения эти симптомы могут усилиться. Большинство симптомов начнет исчезать примерно через 2–4 недели после окончания лечения.
Радиотерапия также может привести к появлению постоянных рубцов на тканях. Воздействие таких рубцов зависит от того, какая область подвергается лечению. Некоторые примеры воздействия рубцов описаны ниже.
Не у всех пациентов обязательно возникнут все эти проблемы. Ваше лечение будет спланировано так, чтобы снизить вероятность возникновения этих проблем. Ваша лечащая команда также научит вас приемам, которые могут помочь вам справиться с этими проблемами.
Другие виды лечения также могут повлиять на глотание. Операция может затронуть участки ротовой полости и горла, что возможно затруднит глотание. Некоторые лекарства для химиотерапии могут приводить к появлению ран в ротовой полости и горле. Это может сделать глотание болезненным.
Контроль проблем с глотанием
Наличие проблем с глотанием называется дисфагией. Ваша лечащая команда поможет вам справиться с дисфагией. Ваша команда включает врачей, медсестер/медбратьев, специалиста по глотанию и клинического врача-диетолога.
Вы будете встречаться со специалистом по глотанию перед началом лечения, а также во время и после него. Этот специалист:
Боль при глотании
Если вы испытываете боль при глотании, ваша лечащая команда даст вам болеутоляющее лекарство, которое поможет вам справиться с болью. Соблюдайте указания вашего врача по приему лекарства. Если оно не помогает, скажите об этом своему врачу или медсестре/медбрату. Существует большое количество разнообразных лекарств, которые могут применяться для устранения такого типа боли.
Аспирация
Если вы испытываете проблемы с глотанием, пища или жидкость могут скапливаться в задней части горла. Это повышает риск аспирации. Признаки аспирации включают:
При возникновении какого-либо из этих признаков немедленно обратитесь к вашему специалисту по глотанию. Этот специалист оценит изменилась ли ваша способность глотать и может порекомендовать продукты питания и напитки, глотать которые безопасно. Вам также окажут помощь в выполнении упражнений для глотания, которые помогут предотвратить ухудшение вашей способности глотать.
Немедленно позвоните вашему врачу или медсестре/медбрату при появлении у вас какого-либо из следующих симптомов:
Это могут быть признаки развития пневмонии или респираторной инфекции.
Тризм
Тризм — это состояние, когда вы не можете открыть рот так широко, как обычно. Тризм может произойти в любое время, сразу после или даже спустя годы после лечения.
Если вы не можете достаточно широко открыть рот, врачу трудно осмотреть ротовую полость. Это может быть связано и с другими проблемами, например:
При возникновении тризма, лечение его очень затруднено. Вот почему важно предотвращать тризм и как можно раньше начинать лечение этого состояния. Ваш специалист по глотанию научит вас выполнять упражнения, которые помогут предотвратить тризм. Также важно соблюдать надлежащую гигиену полости рта и поддерживать правильную осанку.
Физическая нагрузка
Эти упражнения помогут предотвратить ухудшение способности глотать при прохождении радиотерапии. Они также помогут вам сохранить способность глотать с течением времени. Ваш специалист по глотанию скажет, когда начать выполнять эти упражнения. Упражнения не принесут пользы, если вы начнете выполнять их слишком рано после операции или слишком заранее перед началом радиотерапии.
Выполняйте каждое упражнение по 10 повторений 3 раза в день. Если ваш специалист по глотанию скажет выполнять их чаще или реже, следуйте этим рекомендациям.
Упражнения для улучшения глотания
Упражнение с удержанием языка (упражнение Масако)
Между проглатываниями вы можете расслабиться и вернуть язык в нормальное положение.
Упражнение на проглатывание с усилием
Представьте, что проглатываете что-то большое (например полную ложку арахисового масла). Это поможет вам сильно напрячь мышцы.
Упражнение Мендельсона на глотание с маневром
Чтобы сделать паузу, вы можете представить, что задерживаете дыхание во время глотка на 2 секунды перед тем, как расслабиться. Также можно коснуться рукой горла, чтобы почувствовать, когда мышцы поднимаются или напрягаются во время глотания.
Упражнение на глотание для надъязычной области
Упражнение Шейкера
Упражнения на амплитуду движений языка
Упражнение на высовывание языка
Упражнение на втягивание языка
Упражнение на отведение языка в сторону
Упражнение для кончика языка
Упражнение для корня языка
Упражнения для челюстей
Упражнения на амплитуду движений и растяжение
Сядьте или встаньте. При выполнении этих упражнений ваша голова должна оставаться в одном положении.
Рисунок 2. Откройте рот
Рисунок 3. Сместите челюсть влево
Рисунок 4. Сместите челюсть вправо
Упражнение на пассивное растяжение
Рисунок 5. Сделайте дополнительный упор пальцами
Если ваш специалист по глотанию заметит какие-либо изменения в способности глотать, вам могут дать и другие упражнения или рассказать вам о других способах сохранения глотательной функции во время лечения.
Рекомендации по рациону питания
Сбалансированное питание является важной частью лечения рака. Если у вас появилась боль при глотании или возникли проблемы с глотанием:
Ваш специалист по глотанию, медсестра/медбрат, врач и клинический врач-диетолог расскажут, что вам следует есть и пить во время лечения. Ваш специалист по глотанию порекомендует вам продукты и жидкости подходящей консистенции. Когда вы будете пробовать новые продукты и жидкости, следите за тем, чтобы их консистенция соответствовала рекомендованной вашим специалистом по глотанию.
Ваша лечащая команда также может порекомендовать вам прием пищевых добавок (например, Ensure ® ) для увеличения количества потребляемых калорий. Вы можете купить пищевые добавки в ближайшем продуктовом магазине, аптеке или заказать в Интернете.
Контроль сухости во рту или густой слюны
Попробуйте воспользоваться следующими советами, если вам доставляет неприятности сухость во рту или густая слюна:
Контактная информация
Для получения дополнительной информации обратитесь к специалисту по речи и слуху в Центре речи и слуха (Speech and Hearing Center) при Memorial Sloan Kettering (MSK). Вы можете позвонить такому специалисту с понедельника по пятницу с 9:00 до 17:00 по телефону 212-639-5856.
Центр речи и слуха (Speech and Hearing Center) находится в больнице Memorial Hospital по адресу:
1275 York Avenue (между улицами East 67 th Street и East 68 th Street)
4-й этаж здания Bobst (Bobst Building), офис 7
New York, NY 10065
Центр речи и глотания расположен в здании Центра Дэвида Х. Коха (David H. Koch Building) по адресу:
530 East 74 th Street
16-й этаж, офис 11
New York, NY 10021